2021年12月9日,“天宫课堂”第一次授课中,王亚平老师将半粒泡腾片放进水球,水球中开始产生越来越多的气泡。在失重环境下,气泡没有很快离开水球逸散出去,而是被包裹在水球里。这一神奇的现象,激发了某化学实验小组同学们对泡腾片成份进行探究的兴趣。
【阅读说明书】
(1)阅读某维C泡腾片说明书,除含主要成分维生素C(0.5g/片)以外,同学们还发现一种教材中常见的化学物质一碳酸氢钠。学习酸碱盐知识后的同学们熟知NaHCO
3的性质,知道NaHCO
3与稀盐酸反应的化学方程式为
_______。

同学们在成份栏里没有找到稀盐酸,但是却发现了另外两种酸:无水枸橼酸和富马酸。查阅百度,知道无水枸橼酸和富马酸都是较强的有机酸,均会与NaHCO
3反应生成CO
2气体和水,与稀盐酸反应原理相似。
【实验验证】
(2)实验证明泡腾片在水中产生的气体是CO
2的方法是
_______。
【实验探究】
同学们调查发现多种维C泡腾片的说明书中都没有标明每片中NaHCO
3的含量。所以,同学们设计了以下实验(如图所示),探究以上维C泡腾片中NaHCO
3的质量分数。请回答下列问题:

【查阅资料】
①浓硫酸:无色粘稠液体,有吸水性,在化学实验中常用它作干燥剂:
②碱石灰:粉色颗粒状固体,能吸收二氧化碳和水。
【实验步骤】
(3)①按上图所示连接仪器,检查气体发生装置(B装置)气密性的方法是
_______。
②在各仪器中装好足量的试剂,连接好装置,估算出装置内空气的总体积约为550mL:
③用镊子夹取1片维C泡腾片,放在垫有洁净的纸的电子天平上称量,读取其质量为1.74g:
④小心将称取的1片维C泡腾片放入B装置中,立即塞紧橡胶塞。
⑤打开K
1、K
2、K
3,用注射器从左边缓慢通入约600mL空气后,关闭K
1、K
2、K
3:
⑥迅速取下D装置,在电子天平上称量其质量为63.30g,立即连接回原位置:
⑦打开
_______,将注射器中50mL(足量)的水缓缓地全部注入B装置,充分反应,待B中泡腾片全部消失,直到不再产生气泡为止。
⑧打开K
1,再用注射器从左边缓慢通入约600mL空气后,再次称量D装置的质量为63.45g。
【交流讨论】
(4)E装置的作用是
_______。
(5)步骤⑤中要“先从左边缓慢通入约600mL空气”的目的是
_______。
(6)步骤⑧中要“再从左边缓慢通入约600mL空气”的目的是
_______。
【计算】(7)计算该维C泡腾片中碳酸氢钠的质量分数为
_______%(保留两位小数);
【反思】
(8)若将C装置与D装置调换位置,仍以D装置的质量差为计算依据,则计算结果会
_______(选填“偏大”、“偏小”或“不变”)。
(9)有同学认为若泡腾片中酸反应完,而NaHCO
3没有反应完,计算结果会偏小。所以,需补做一个简单实验:
_______,即可证明泡腾片中所含的NaHCO
3已经完全反应。

 。
。
 中,Mn的化合价变化:
中,Mn的化合价变化:


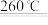 MgO+H2O,CaCO3
MgO+H2O,CaCO3 CaO+CO2↑。某水垢为Mg(OH)2、CaCO3的混合物,现进行如下实验:称取25.8g此水垢,加热一段时间后,固体质量变为19.6g。将产生的气体通入足量石灰水中,得到10.0g固体。下列说法不正确的是
CaO+CO2↑。某水垢为Mg(OH)2、CaCO3的混合物,现进行如下实验:称取25.8g此水垢,加热一段时间后,固体质量变为19.6g。将产生的气体通入足量石灰水中,得到10.0g固体。下列说法不正确的是







