全一卷
1.下列属于纯净物的是
| A.空气 | B.液氮 | C.食醋 | D.青铜 |
2.下列化学用语正确的是
| A.金刚石—C | B.镁离子—Mg+2 |
| C.氧化铝—AlO | D.氯酸钾—KCl |
3.下列物质的用途主要与化学性质有关的是
| A.用石墨作电池电极 | B.用干冰进行人工降雨 |
| C.用稀盐酸除去铁锈 | D.用大理石作建筑材料 |
4.下列符合“安全、健康、绿色、舒适”的生产生活理念的是
| A.煤气泄漏,开灯检查 | B.明矾净水,杀菌消毒 |
| C.植树造林,防沙降尘 | D.焚烧秸秆,增肥环保 |
5.下列归类正确的是
| 选项 | 归类 | 内容 |
| A | 营养物质 | 糖类、油脂、蛋白质 |
| B | 常见氮肥 | 碳铵、尿素、碳酸钾 |
| C | 常见的碱 | 火碱、氨水、生石灰 |
| D | 合成材料 | 涤纶、塑料、棉纱线 |
| A.A | B.B | C.C | D.D |
6.实验室制备氢气并获得ZnSO4•7H2O,下列图示装置和操作不能达到实验目的的是
A.稀释浓硫酸 | B.制备H2 |
C.收集H2 | D.制得ZnSO4•7H2O |
7.下列实验方法正确的是
| A.用50mL量筒量取6.5mL稀硫酸 |
| B.用淀粉溶液区分加碘盐和无碘盐 |
| C.用酚酞试液检验NaOH溶液是否变质 |
| D.用Cu与AgNO3溶液反应比较两金属活动性 |
8.下列排序正确的是
A.空气中物质含量: |
B.溶液的pH: |
C.利用金属的年代: |
D.氮元素化合价: |
9.下列指定反应的化学方程式正确的是
| A.硫酸型酸雨的形成:SO2+H2O=H2SO4 |
| B.铁粉溶于稀硫酸:2Fe+3H2SO4=Fe2(SO4)3+3H2↑ |
C.镁粉着火不能用CO2灭火的原因:2Mg+CO2 2MgO+C 2MgO+C |
| D.Na2O2与CO2反应生成纯碱和氧气:Na2O2+CO2=Na2CO3+O2 |
10.物质甲、乙均可灭杀新型冠状病毒(2019﹣nCoV),灭杀过程中有如图转化。

下列说法正确的是

下列说法正确的是
| A.转化①是化合反应 |
| B.乙的溶液应避光保存 |
| C.转化过程中共有三种氧化物 |
| D.甲、乙、丙中氯元素的质量分数依次降低 |
11.侯氏制碱法为NaCl+NH3+H2O+CO2=X+NH4Cl。下列说法不正确的是
| A.NaCl可由海水蒸发结晶后精制获得 |
| B.CO2可由海边的贝壳煅烧获得 |
| C.X为Na2CO3,可治疗胃酸过多 |
| D.NH4Cl可作化肥,不能与草木灰混合施用 |
12.利用如图装置研究碱式碳酸铜的性质。下列说法不正确的是


| A.装置①中固体由绿色变为黑色 |
| B.装置②③中出现的现象,可证明有H2O和CO2生成 |
| C.取装置①中剩余固体,加入稀硫酸,振荡,溶液变蓝 |
| D.将装置②中固体改为足量碱石灰,仍可证明有H2O和CO2生成 |
13.下列物质的转化在给定条件下均能实现的是
A.H2O2 O2 O2 Fe2O3 Fe2O3 |
B.CuSO4溶液 Cu(OH)2悬浊液 Cu(OH)2悬浊液 Cu2O Cu2O |
C.Na2SO4溶液 NaCl溶液 NaCl溶液 NaOH溶液 NaOH溶液 |
D.Na2CO3溶液 CaCO3 CaCO3 Ca(OH)2 Ca(OH)2 |
14.下列实验操作不能达到实验目的的是
选项 | 物质 | 目的 | 主要实验操作 |
A | 硬水和软水 | 鉴别 | 取样,分别加适量肥皂水振荡,观察现象 |
B | CO2中是否混有SO2 | 检验 | 通入KMnO4稀溶液中,观察溶液是否褪色 |
C | Na2CO3中混有NaHCO3 | 除杂 | 将固体加热至质量不再发生变化 |
D | CaCl2、NaCl混合溶液 | 分离 | 通入CO2过滤、洗涤,再滤渣中滴加适量稀盐酸 |
| A.A | B.B | C.C | D.D |
15.如图为一种烟气脱硫的流程。下列说法不正确的是


| A.烟气脱硫能减少酸雨的形成 |
B.脱硫塔中发生的主要反应为CaS+SO2+O2 CaSO4+S CaSO4+S |
| C.理论上,生产过程中无需补充CaS |
| D.理论上每处理64.0g SO2,可回收32.0g S粉,同时排放出44.0g CO2 |
16.如图为KCl和Na2CO3的溶解度曲线,下列说法不正确的是


| A.T2℃时,Na2CO3饱和溶液质量分数为49.0% |
| B.将两物质的饱和溶液由T1℃升温至T3℃,均无固体析出 |
| C.T4℃时,分别将等质量的KCl和Na2CO3溶于水配成饱和溶液,所得溶液的质量前者小于后者 |
| D.若KCl溶液中含有少量Na2CO3,可采取蒸发浓缩、控制温度T2℃以上降温结晶、过滤等操作提纯 |
17.下列各组溶液,不用其他试剂就不能鉴别出来的是
| A.CuSO4、Na2SO4、Ba(NO3)2、KCl |
| B.FeCl3、BaCl2、NaOH、KNO3 |
| C.AgNO3、Na2CO3、HCl、HNO3 |
| D.MgSO4、KOH、Ba(OH)2、HNO3 |
18.下列说法不正确的是
| A.同种元素的原子和离子具有相同的质子数 |
| B.稀硫酸、盐酸中都含有大量H+,所以具有相似的化学性质 |
| C.称取5.0g熟石灰,加入95.0mL水充分搅拌,得到5.0%的Ca(OH)2溶液 |
| D.向盐酸与氢氧化钠充分反应后的溶液中滴入酚酞试液,不变色,则二者恰好完全中和 |
19.将Ba(OH)2溶液滴入H2SO4、CuSO4的100.0g混合溶液中,测得产生的沉淀质量与滴加Ba(OH)2溶液体积的关系如图所示。下列说法正确的是
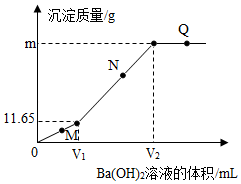

| A.M点溶液的pH小于Q点 |
| B.N点溶液中有两种溶质 |
| C.混合溶液中H2SO4的质量分数为9.8% |
| D.若V1:V2=1:3,则m=44.75 |
20.已知:Mg(OH)2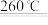 MgO+H2O,CaCO3
MgO+H2O,CaCO3 CaO+CO2↑。某水垢为Mg(OH)2、CaCO3的混合物,现进行如下实验:称取25.8g此水垢,加热一段时间后,固体质量变为19.6g。将产生的气体通入足量石灰水中,得到10.0g固体。下列说法不正确的是
CaO+CO2↑。某水垢为Mg(OH)2、CaCO3的混合物,现进行如下实验:称取25.8g此水垢,加热一段时间后,固体质量变为19.6g。将产生的气体通入足量石灰水中,得到10.0g固体。下列说法不正确的是
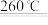 MgO+H2O,CaCO3
MgO+H2O,CaCO3 CaO+CO2↑。某水垢为Mg(OH)2、CaCO3的混合物,现进行如下实验:称取25.8g此水垢,加热一段时间后,固体质量变为19.6g。将产生的气体通入足量石灰水中,得到10.0g固体。下列说法不正确的是
CaO+CO2↑。某水垢为Mg(OH)2、CaCO3的混合物,现进行如下实验:称取25.8g此水垢,加热一段时间后,固体质量变为19.6g。将产生的气体通入足量石灰水中,得到10.0g固体。下列说法不正确的是| A.加热产生了1.8g水 |
| B.剩余固体为MgO和CaO的混合物 |
| C.水垢中Mg(OH)2与CaCO3的质量比为29:50 |
| D.取两份质量相同的水垢,一份直接与盐酸反应,一份加热后再与盐酸反应,消耗HCl的质量相等 |
21.用化学符号表示:
(1)磷元素______ ;
(2)最常见的溶剂______ ;
(3)3个氧原子______ ;
(4)儿童缺少______ 元素严重时,会导致侏儒症。
(1)磷元素
(2)最常见的溶剂
(3)3个氧原子
(4)儿童缺少
22.选择下列适当的物质填空(填序号)。
A.氧气 B.不锈钢 C.活性炭 D.聚氯乙烯 E.硫酸 F.聚乙烯 G.熟石灰 H.武德合金
(1)可用于医疗急救的是______ ;
(2)可用于制保险丝的是______ ;
(3)用于冰箱除异味的是______ ;
(4)铅蓄电池含有的酸是______ ;
(5)可改良酸性土壤的是______ ;
(6)可用于食品包装的是______ 。
A.氧气 B.不锈钢 C.活性炭 D.聚氯乙烯 E.硫酸 F.聚乙烯 G.熟石灰 H.武德合金
(1)可用于医疗急救的是
(2)可用于制保险丝的是
(3)用于冰箱除异味的是
(4)铅蓄电池含有的酸是
(5)可改良酸性土壤的是
(6)可用于食品包装的是
23.某航天器能量储存系统的工作原理如图。
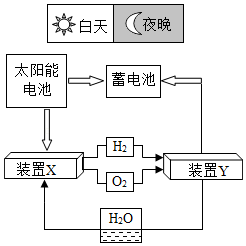
(1)装置X中发生反应的化学方程式为______ 。
(2)装置Y是将______ 能转为______ 能(填“电”或“化学”)。

(1)装置X中发生反应的化学方程式为
(2)装置Y是将
24.我国力争在2060年前实现碳中和”,体现了中国对解决气候问题的大国担当。碳中和,即通过植树造林、节能减排等形式,抵消自身产生的CO2排放,实现CO2“零排放”。
(1)“碳”排放
①化石燃料的燃烧是CO2排放的主要因素。化石燃料主要包括煤炭、______ 和天然气。
②下列对节能减排的建议可行的是______ (填字母)。
a.停止使用化石燃料
b.推广使用光伏发电
c.鼓励民众公交出行
d.生活垃圾集中焚烧
(2)“碳”吸收。自然界有多种途径吸收CO2。
①绿色植物通过______ 吸收CO2。
②风化的岩石如CaCO3粉末可吸收空气中的CO2和H2O转化为Ca(HCO3)2,反应的化学方程式为______ 。
(3)“碳”捕捉。利用NaOH捕捉CO2,得到高纯度CO2的流程如图。
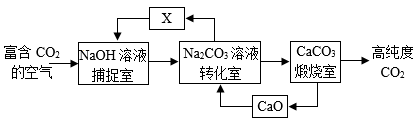
转化中可循环使用的物质有CaO和X,则X的化学式为______ 。
(4)“碳”利用。将CO2作为资源是实现碳中和的有效方法。以CO2和H2为原料,在一定条件可合成C2H6O,参加反应的CO2和H2的质量比为______ 。

(1)“碳”排放
①化石燃料的燃烧是CO2排放的主要因素。化石燃料主要包括煤炭、
②下列对节能减排的建议可行的是
a.停止使用化石燃料
b.推广使用光伏发电
c.鼓励民众公交出行
d.生活垃圾集中焚烧
(2)“碳”吸收。自然界有多种途径吸收CO2。
①绿色植物通过
②风化的岩石如CaCO3粉末可吸收空气中的CO2和H2O转化为Ca(HCO3)2,反应的化学方程式为
(3)“碳”捕捉。利用NaOH捕捉CO2,得到高纯度CO2的流程如图。

转化中可循环使用的物质有CaO和X,则X的化学式为
(4)“碳”利用。将CO2作为资源是实现碳中和的有效方法。以CO2和H2为原料,在一定条件可合成C2H6O,参加反应的CO2和H2的质量比为
25.以碳酸钡原料(含少量SiO2)制备高纯碳酸钡的流程如图。

(1)试剂X应选用______ (填字母)。
a.稀硫酸b.盐酸
(2)操作1、操作2用到的玻璃仪器有______ 、烧杯、玻璃棒等。
(3)滤液Y中溶质有KOH、K2CO3和______ 。
(4)酸溶时,试剂X不能过量太多,一是节约试剂X,二是______ 。

(1)试剂X应选用
a.稀硫酸b.盐酸
(2)操作1、操作2用到的玻璃仪器有
(3)滤液Y中溶质有KOH、K2CO3和
(4)酸溶时,试剂X不能过量太多,一是节约试剂X,二是
26.如图表示工业生产中吸收SO2和NO2的原理。

(1)脱硫中,溶液的pH______ (填“变大”“不变”或“变小”)。
(2)脱硝时,反应的化学方程式为______ 。

(1)脱硫中,溶液的pH
(2)脱硝时,反应的化学方程式为
27.请结合如图回答问题。

(1)仪器名称:①______ ,②______ 。
(2)用高锰酸钾制取氧气可选用装置A和______ (填字母)组合,反应的化学方程式为______ ,试管中棉花团的作用是______ 。
(3)实验室制取CO2的化学方程式为______ ,选用装置C相对B的优点是______ 。
(4)已知CaCl2的水溶液呈中性。用图1装置探究制取CO2的实验。实验开始时,向锥形瓶中加入一定量的盐酸图2表示实验过程中装置G和Ⅰ中的溶液pH变化曲线。

①装置H的作用为______ 。
②t1时,锥形瓶中石灰石有剩余,无气泡产生。请判断t2时,锥形瓶中______ (填“有”或“无”)盐酸剩余。
③t1后,显示器B中曲线几乎无变化,其原因是______ 。

(1)仪器名称:①
(2)用高锰酸钾制取氧气可选用装置A和
(3)实验室制取CO2的化学方程式为
(4)已知CaCl2的水溶液呈中性。用图1装置探究制取CO2的实验。实验开始时,向锥形瓶中加入一定量的盐酸图2表示实验过程中装置G和Ⅰ中的溶液pH变化曲线。

①装置H的作用为
②t1时,锥形瓶中石灰石有剩余,无气泡产生。请判断t2时,锥形瓶中
③t1后,显示器B中曲线几乎无变化,其原因是
28.用如图装置对镁及其化合物的性质进行实验探究。
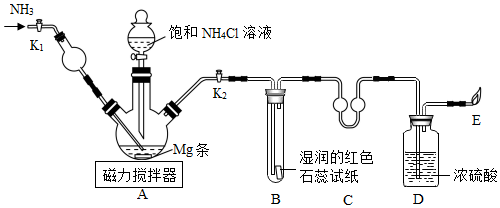
步骤一:将打磨过的镁条放入三颈烧瓶中,关闭K1、打开K2,加入一定量饱和NH4Cl溶液,观察到镁条溶解,形成无色溶液,产生大量气泡。试管B中石蕊试纸变为蓝色。点燃E处气体产生淡蓝色火焰。
①点燃E处气体前,必须进行的操作是______ 。
②镁条与NH4Cl溶液反应的化学方程式为______ 。
步骤二:已知:NH3+H2O=NH3•H2O。打开K1,通入少量NH3观察到溶液变浑浊。过滤、洗净、低温烘干得白色固体。
①某同学猜想此白色固体是Mg(OH)2,理由是______ (用化学方程式表示)。
②取少量白色固体,溶于适量的稀硝酸,再滴加AgNO3溶液,观察到______ ,则该同学猜想不正确。
资料:此白色固体为碱式氯化镁[Mgx(OH)yClz],其不溶于水,能与酸反应,加热分解生成MgO、H2O和HCl。
步骤三:取一定量白色固体,充分加热,残留2.40g固体,将生成的气体用足量的AgNO3溶液吸收,生成5.74g沉淀。则白色固体的化学式为______ 。
问题讨论:若步骤三中生成的气体未被AgNO3溶液完全吸收,则测得的Mgx(OH)yClz中y值______ (填“偏大”“不变”或“偏小”)。

步骤一:将打磨过的镁条放入三颈烧瓶中,关闭K1、打开K2,加入一定量饱和NH4Cl溶液,观察到镁条溶解,形成无色溶液,产生大量气泡。试管B中石蕊试纸变为蓝色。点燃E处气体产生淡蓝色火焰。
①点燃E处气体前,必须进行的操作是
②镁条与NH4Cl溶液反应的化学方程式为
步骤二:已知:NH3+H2O=NH3•H2O。打开K1,通入少量NH3观察到溶液变浑浊。过滤、洗净、低温烘干得白色固体。
①某同学猜想此白色固体是Mg(OH)2,理由是
②取少量白色固体,溶于适量的稀硝酸,再滴加AgNO3溶液,观察到
资料:此白色固体为碱式氯化镁[Mgx(OH)yClz],其不溶于水,能与酸反应,加热分解生成MgO、H2O和HCl。
步骤三:取一定量白色固体,充分加热,残留2.40g固体,将生成的气体用足量的AgNO3溶液吸收,生成5.74g沉淀。则白色固体的化学式为
问题讨论:若步骤三中生成的气体未被AgNO3溶液完全吸收,则测得的Mgx(OH)yClz中y值
29.现有一包固体粉末,可能含有Na2SO4、Cu(NO3)2、KOH、BaCl2、Mg(NO3)2、Na2CO3中的一种或几种。现做如下实验:
(1)取少量固体加水溶解,过滤得白色固体A和无色滤液B,则原固体中一定不含有______ 。
(2)向固体A中加入稀盐酸,产生气泡,则原固体中一定含有______ ;继续加入稀盐酸,固体全部溶解,振荡后加入过量的NaOH溶液,无明显现象,则原固体中一定还含有______ ,一定不含有______ 。
(3)取少量滤液B,滴入几滴酚酞试液,无明显现象,则原固体中一定不含有______ 。
(1)取少量固体加水溶解,过滤得白色固体A和无色滤液B,则原固体中一定不含有
(2)向固体A中加入稀盐酸,产生气泡,则原固体中一定含有
(3)取少量滤液B,滴入几滴酚酞试液,无明显现象,则原固体中一定不含有
30.铁及其化合物在生产生活中发挥着重要作用。
(一)铁的冶炼和应用
(1)我国早在春秋战国时期就开始生产和使用铁器。

①深埋的古墓中有些铁器保存至今是因为______ (填字母)。
a.铁不活泼 b.密封缺氧 c.干燥少水
②胆碱为CuSO4晶体,《梦溪笔谈》记载“熬胆矾铁釜久亦化为铜”,用化学方程式表示其原理:______ 。
(2)用赤铁矿高炉炼铁,反应的化学方程式为______ 。生铁炼钢,主要是降低______ 元素含量,除去生铁中硅、硫和磷等元素。
(3)硫酸亚铁可作为补铁剂,其药片表面包裹着用淀粉制作的糖衣,淀粉属于______ (填“无机物”或“有机物”)。如无此糖衣,FeSO4暴露在空气中转化成Fe(OH)SO4而失效,转化的化学方程式为______ 。
(二)铁红(Fe2O3)的制备
用工业烧渣(含有Fe2O3、FeO和SiO2)制备化工原料铁红的实验流程如图2:
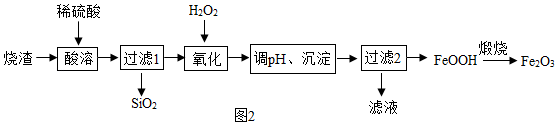
(4)酸溶前将烧渣粉碎,目的是______ 。写出酸溶时发生的一个化学方程式______ 。
(5)氧化时发生的反应为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O反应温度不宜太高,原因是______ 。
(6)过滤2所得固体必须洗涤,判断固体已经洗净的方法是______ 。
(三)铁触媒的制备
铁触媒是工业合成氨的催化剂,主要成分为Fe3O4。用下列装置对铁触媒的制备进行研究。取48.00g铁红置于装置A中,控制不同的温度对其加热,测得装置B和C的质量变化如表。
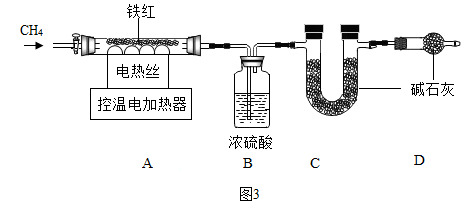
表:装置B和C的质量变化
资料:加热到500℃以上,Fe2O3和CH4开始反应,生成铁的其他氧化物、CO2和H2O。温度高于700℃,生成Fe。
(7)装配好实验装置后,先要______ 。
(8)加热前后及过程中均需通入CH4,加热前通CH4的目的是______ 。
(9)加热到650℃时,装置A中剩余固体为FeO和Fe3O4的混合物,则两物质的质量比m(FeO):m(Fe3O4)=______ 。
(10)用铁红制取铁触媒,装置A应控制的适宜温度为______ ℃。
(一)铁的冶炼和应用
(1)我国早在春秋战国时期就开始生产和使用铁器。

①深埋的古墓中有些铁器保存至今是因为
a.铁不活泼 b.密封缺氧 c.干燥少水
②胆碱为CuSO4晶体,《梦溪笔谈》记载“熬胆矾铁釜久亦化为铜”,用化学方程式表示其原理:
(2)用赤铁矿高炉炼铁,反应的化学方程式为
(3)硫酸亚铁可作为补铁剂,其药片表面包裹着用淀粉制作的糖衣,淀粉属于
(二)铁红(Fe2O3)的制备
用工业烧渣(含有Fe2O3、FeO和SiO2)制备化工原料铁红的实验流程如图2:

(4)酸溶前将烧渣粉碎,目的是
(5)氧化时发生的反应为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O反应温度不宜太高,原因是
(6)过滤2所得固体必须洗涤,判断固体已经洗净的方法是
(三)铁触媒的制备
铁触媒是工业合成氨的催化剂,主要成分为Fe3O4。用下列装置对铁触媒的制备进行研究。取48.00g铁红置于装置A中,控制不同的温度对其加热,测得装置B和C的质量变化如表。

表:装置B和C的质量变化
温度/℃ | 装置B/g | 装置C/g |
室温 | 300.00 | 400.00 |
550 | 300.45 | 400.55 |
600 | 300.90 | 401.10 |
650 | 301.80 | 402.20 |
资料:加热到500℃以上,Fe2O3和CH4开始反应,生成铁的其他氧化物、CO2和H2O。温度高于700℃,生成Fe。
(7)装配好实验装置后,先要
(8)加热前后及过程中均需通入CH4,加热前通CH4的目的是
(9)加热到650℃时,装置A中剩余固体为FeO和Fe3O4的混合物,则两物质的质量比m(FeO):m(Fe3O4)=
(10)用铁红制取铁触媒,装置A应控制的适宜温度为
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
