
| 实验 | 溶液1(1mL) | 溶液2(10mL) | 现象 |
| A | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液 | 溶液1与溶液2混合后,实验A、B、C所得溶液红色依次加深 |
| B | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液,用NaOH固体调 pH=5.0 | |
| C | 0.1mol·L-1 FeCl3溶液 | _______ |
 的实验证据是
的实验证据是| 序号 | 实验a | 实验b |
| 方案 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,测得pH=1.7 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,加几滴浓盐酸,调pH=1.3 |
| 现象 | 放置10分钟后,溶液红色均褪去,实验b中溶液褪色更快。经检验,褪色后的溶液中均存在Fe2+。 | |
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。 还原性的影响是
还原性的影响是 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。实验序号 | 0.01mol/L KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol/L Na2SO3溶液的体积/mL | 水的 体积/mL | 实验 温度/℃ | 记录出现蓝色的时间/s |
① | 5 | 5 | V1 | 0 | t1 |
② | 5 | 5 | 40 | 25 | t2 |
③ | 5 | V2 | 35 | 25 | t3 |
 的平衡常数K
的平衡常数K 的总浓度。
的总浓度。
编号 | 250mL碘量瓶① | 250mL碘量瓶② |
试剂 | 0.5g研细的碘 60mL 0.010 mol/L KI溶液 | 0.5g研细的碘 60mL H2O |
I2和I | 0.00500 mol/L | 0.0012 mol/L |
 与②中
与②中 接近,列出平衡常数K的计算式
接近,列出平衡常数K的计算式 ②
②

 (无机试剂任用)
(无机试剂任用) A.加热,蒸干X与足量盐酸反应后的溶液,可得固体 g g |
B.Y充分加热,固体质量减少 g g |
| C.X、Y消耗盐酸的物质的量之比为1:1 |
D.混合物中Na2CO3和NaHCO3的物质的量之比为 |

 的含氧弱酸,其物质的量为
的含氧弱酸,其物质的量为 。
。 和
和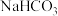 混合物样品的组成,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸
混合物样品的组成,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸 ,充分反应,产生
,充分反应,产生 的体积如下表(已折算成标准状况下的体积,不考虑
的体积如下表(已折算成标准状况下的体积,不考虑 在水中的溶解。)
在水中的溶解。)| 实验序号 | ① | ② | ③ |
V(盐酸)/ | 50.0 | 50.0 | 50.0 |
| m(样品)/g | 1.90 | 3.80 | 5.70 |
 | 448 | 672 | 448 |
A.样品中 的质量分数约为55.8% 的质量分数约为55.8% |
B.实验③溶液蒸干灼烧后所得固体为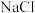 |
C.盐酸的物质的量浓度 |
D.当样品质量约为 时,产生 时,产生 最多,此时参加反应的 最多,此时参加反应的 |

 M,H2S
M,H2S N,M是下列物质中的
N,M是下列物质中的

 CH3OH(g)+H2O(g) △H1=-49.2kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.2kJ•mol-1 CO(g)+H2O(g) △H2=+41.2kJ•mol-1
CO(g)+H2O(g) △H2=+41.2kJ•mol-1

 SO3(g)+NO(g) △H<0。在固定容积的密闭容器中使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率,部分实验结果如图所示。
SO3(g)+NO(g) △H<0。在固定容积的密闭容器中使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率,部分实验结果如图所示。
 点的平衡状态改变为B点的平衡状态,应采取的措施是
点的平衡状态改变为B点的平衡状态,应采取的措施是 点对应实验中SO2(g)的起始浓度为c0mol•L-1,经过tmin达到平衡状态,该时段的化学反应速率v(NO2)=
点对应实验中SO2(g)的起始浓度为c0mol•L-1,经过tmin达到平衡状态,该时段的化学反应速率v(NO2)= 4NO(g)+CO2(g)+2H2O(g) K1
4NO(g)+CO2(g)+2H2O(g) K1 2N2(g)+CO2(g)+2H2O(g) K2
2N2(g)+CO2(g)+2H2O(g) K2 CO2(g)+N2(g),在160℃、220℃条件下,分别向两刚性容器中充入2molCO和2molN2O,实验测得两容器中CO或CO2的物质的量随时间变化如图:
CO2(g)+N2(g),在160℃、220℃条件下,分别向两刚性容器中充入2molCO和2molN2O,实验测得两容器中CO或CO2的物质的量随时间变化如图:
 CH3OH(g)+H2O(g) △H1=-49.4kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ•mol-1 CO(g)+H2O(g) △H2=41.1kJ•mol-1
CO(g)+H2O(g) △H2=41.1kJ•mol-1 ×100%。
×100%。
 ,下列说法正确的是
,下列说法正确的是| A.该反应中,有三种元素化合价发生改变 |
B.该反应的还原剂为 和 和 ,氧化产物为 ,氧化产物为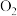 和 和 |
C.1.5mol 参加反应,被 参加反应,被 还原的 还原的 为0.4mol 为0.4mol |
D.1.5mol 参加反应,有4mol 参加反应,有4mol 转移 转移 |