 、
、 、
、 、
、 、
、 等离子,从该分金液中回收所有金属资源及硫的工艺流程如图所示:
等离子,从该分金液中回收所有金属资源及硫的工艺流程如图所示:
 作电解液进行精炼时,粗金板表面因附着生成的AgCl发生钝化。可通过直流电叠加交流电进行不对称脉动电流电解,阳极上周期性出现正、负半周期。在正半周期,银发生极化形成钝化膜;在负半周期发生去极化,其电极反应式为
作电解液进行精炼时,粗金板表面因附着生成的AgCl发生钝化。可通过直流电叠加交流电进行不对称脉动电流电解,阳极上周期性出现正、负半周期。在正半周期,银发生极化形成钝化膜;在负半周期发生去极化,其电极反应式为 将
将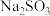 或
或 ,两者信息如下表所示。从价格上分析,最佳试剂为
,两者信息如下表所示。从价格上分析,最佳试剂为 年分金液的量计算,理论上每年可节约成本
年分金液的量计算,理论上每年可节约成本| 消耗物料 | 消耗量/ | 单价/元 |
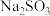 | 22.0 | 2.7 |
 | 13.0 | 4.2 |


 的产生有两个途径:
的产生有两个途径: 被氧化为SO
被氧化为SO 进入D。
进入D。 的产生途径
的产生途径 )常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、苂光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量
)常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、苂光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量 、
、 、
、 、
、 等)制备高纯碳酸锶的工艺流程如下:
等)制备高纯碳酸锶的工艺流程如下:
 为两性氢氧化物;
为两性氢氧化物;| 化合物 |  |  |  |  |
 近似值 近似值 |  |  |  |  |
 的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入

 +______CrO
+______CrO +______
+______ =______Cl-+______CrO
=______Cl-+______CrO +______H2O
+______H2O 
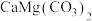 ,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。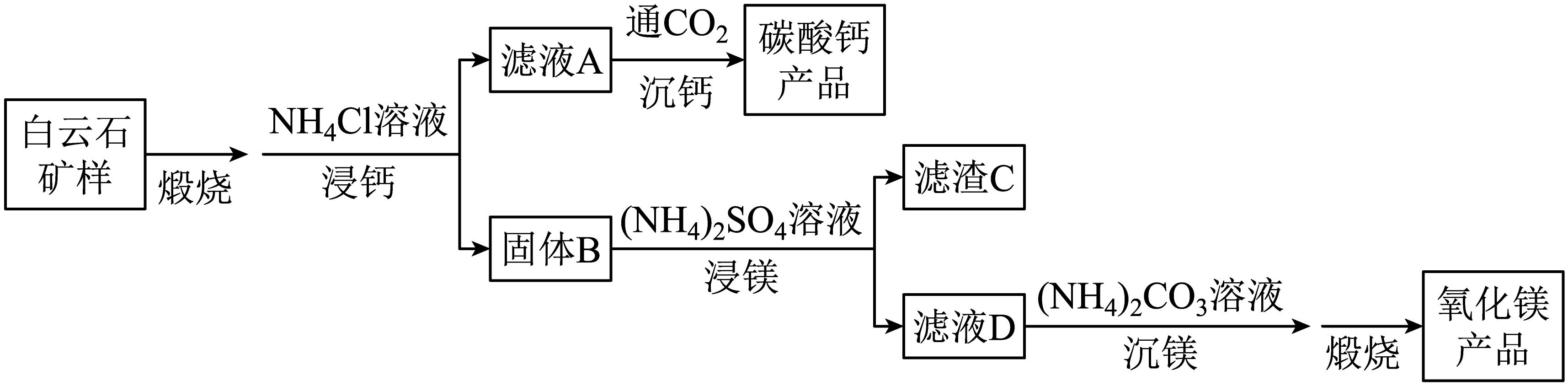
| 物质 |  |  |  |  |
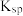 |  |  |  |  |
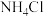 用量对碳酸钙产品的影响如下表所示。
用量对碳酸钙产品的影响如下表所示。 | 氧化物(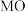 )浸出率/% )浸出率/% | 产品中 纯度/% 纯度/% | 产品中Mg杂质含量/% (以  计) 计) | ||
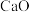 |  | 计算值 | 实测值 | ||
| 2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
| 2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
| 2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
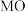 浸出率=(浸出的
浸出率=(浸出的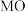 质量/煅烧得到的
质量/煅烧得到的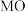 质量)
质量)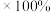 (M代表Ca或Mg)
(M代表Ca或Mg) 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。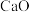 的原因是
的原因是 的比例为
的比例为 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是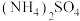 溶液混合,充分反应后
溶液混合,充分反应后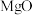 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏,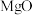 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
 ],则消耗标准状况下气体X的体积是
],则消耗标准状况下气体X的体积是 (装置如图)。为探究pH对AsO
(装置如图)。为探究pH对AsO 氧化性的影响,测得输出电压与pH的关系如图2所示。则a点时,盐桥中
氧化性的影响,测得输出电压与pH的关系如图2所示。则a点时,盐桥中

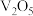 为正极、Zn箔为负极、
为正极、Zn箔为负极、 溶液作电解质溶液。实验室以含矾废料(含
溶液作电解质溶液。实验室以含矾废料(含 、CuO、MnO、
、CuO、MnO、 、
、 、有机物等)为原料制备
、有机物等)为原料制备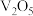 的一种流程如图所示:
的一种流程如图所示:
| 难溶电解质 |  |  |  | CuS |
 |  |  |  |  |
 ,
, 开始沉淀和完全沉淀时溶液的pH分别为
开始沉淀和完全沉淀时溶液的pH分别为 ,认为该离子沉淀完全;
,认为该离子沉淀完全; )。
)。 在溶液中存在着微弱的电离平衡
在溶液中存在着微弱的电离平衡 ,进行下面的实验。
,进行下面的实验。 溶液中逐滴加入氨水至过量,反应的现象为
溶液中逐滴加入氨水至过量,反应的现象为 溶液,无现象;第二支试管中,滴加
溶液,无现象;第二支试管中,滴加 溶液,有黑色的沉淀生成。分析这两种实验现象,得出的结论是
溶液,有黑色的沉淀生成。分析这两种实验现象,得出的结论是 溶液,并过滤,得到无色滤液,说明的问题及解释是
溶液,并过滤,得到无色滤液,说明的问题及解释是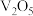 作为
作为 电池正极,材料通过的
电池正极,材料通过的 和质子共嵌入实现的,已知
和质子共嵌入实现的,已知 的嵌入生成了
的嵌入生成了 ,用电极反应式表示为
,用电极反应式表示为 CO(g)+H2O(g) △H1=+41kJ·mol-1
CO(g)+H2O(g) △H1=+41kJ·mol-1 CH4(g)+H2O(g) △H2=-264kJ·mol-1
CH4(g)+H2O(g) △H2=-264kJ·mol-1 C(s)+H2O(g) △H3=-131kJ·mol-1
C(s)+H2O(g) △H3=-131kJ·mol-1 CH4(g)+CO2(g)的△H=
CH4(g)+CO2(g)的△H=
| A.上述反应达平衡后,若压缩容器体积,反应I平衡不移动 |
| B.升高温度可以增大CO的选择性 |
| C.反应I在Fe3O4催化剂表面反应的主要历程是中间物种分解历程 |
| D.氧化还原历程的控速步骤为CO(a)+H2O(a)→CO(g)+H2O(g) |
 =4,P=1atm(atm表示标准大气压),在恒容密闭容器中,,若只发生反应Ⅰ、Ⅱ,平衡时各物质的量分数随温度的变化如图2所示:
=4,P=1atm(atm表示标准大气压),在恒容密闭容器中,,若只发生反应Ⅰ、Ⅱ,平衡时各物质的量分数随温度的变化如图2所示:
 CH3OH(g)+H2O(g) △H3=-50kJ·mol-1。
CH3OH(g)+H2O(g) △H3=-50kJ·mol-1。
 之间的关系,A、B、D、E分别代表图2中a点、c点的速率常数,点
之间的关系,A、B、D、E分别代表图2中a点、c点的速率常数,点
 C2H4(g)+2HI(g)
C2H4(g)+2HI(g) 
 2C3H6(g)
2C3H6(g) 
 C4H8(g)
C4H8(g) 

| A.曲线a表示反应温度对平衡体系中乙烯物质的量分数的影响 |
| B.由图像可知,温度越高,催化剂的活性越强 |
| C.715K时,C4H8(g)的平衡物质的量浓度为0.1mol/L |
| D.400K时使用活性更强的催化剂,可以提高曲线a、b对应物质的物质的量分数 |
 的资源化利用是实现“碳达峰碳中和”的重要途径。
的资源化利用是实现“碳达峰碳中和”的重要途径。 合成甲醇的过程中涉及如下反应。
合成甲醇的过程中涉及如下反应。

| 化学键 |  |  |  |  |  |
键能/ | 754 | 403 | 459 | 446 | 309 |

 合成甲醇的过程,增大压强,
合成甲醇的过程,增大压强, 的平衡体积分数
的平衡体积分数 ,其中
,其中 、
、 分别为正、逆速率常数,则升高温度
分别为正、逆速率常数,则升高温度 会
会 合成甲醇实验。初始压强为
合成甲醇实验。初始压强为 ,起始投料
,起始投料 、
、 均为
均为
 和
和 的平衡转化率随温度变化曲线如图所示。
的平衡转化率随温度变化曲线如图所示。
 ”或“
”或“ ”)表示
”)表示 的平衡转化率。
的平衡转化率。 后曲线
后曲线 随温度升高而降低的原因为
随温度升高而降低的原因为 下,反应达到平衡时,
下,反应达到平衡时, 的物质的量
的物质的量

 ,
, ,其中
,其中 为各组分的平衡分压)。
为各组分的平衡分压)。