你知道什么是酸碱吗?
中学我们认识知道,酸是在水溶液中电离出的阳离子全部为氢离子的物质,碱是在水溶液中电离出的阴离子全部为氢氧根离子的物质。而事实上,酸碱的定义随着历史发展也在不断革新,历代化学家发表了不同的酸碱理论,目前较为广泛接受的有离子论,溶剂论,质子论,电子论和软硬酸碱理论,在此处针对溶剂论和质子论做简单介绍。
溶剂论是1905年富兰克林提出的一种按照纯溶剂是否能够自耦电离(例如水的自耦电离:2H
2O

H
3O
++OH
-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N
2O
4中发生自耦电离N
2O
4
NO
++NO
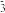
,此时NO
+即为该溶液的酸,NO
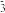
即为该溶液的碱。
据此回答第( 1 )题。
(1)①已知液氨会自耦电离,请类比水的自耦电离写出其自耦电离方程式:
_______,其中,
_______为液氨溶液的酸,
_______为液氨溶液的碱。此时的酸碱中和反应可以写成(写出方程式):
_______。
②写出氯气在液氨溶液中反应的离子方程式:
_______。
质子论是1923年由布朗斯特和劳里提出的,其定义酸为可以给出质子的物种,碱定义为可以接受质子的物种,因此存在关系:

,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。
(2)①下列说法正确的是
_______。
A.因为在水溶液中有 H
2SO
4
2H
++SO
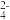
,因此 H
2SO
4 与 SO
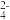
互为共轭酸碱对
B.由于水可以发生自耦电离,则按照该理论,水既属于酸又属于碱
C.可以根据HNO
3的性质推断NO
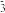
的酸性较弱
D.液氨对碳酸和盐酸是区分溶剂,可以便于区分酸性的强弱
②对于反应NH
3+HCl=NH
4Cl而言,
_______是酸
_______是碱。
③在溶液中,酸的强度是依靠其电离平衡常数

来判断的。

越大则证明电离程度越大,故酸性越强。
对于一种酸HA,其电离平衡常数为:HA

H
++A
-,其中

,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。
实验证明,盐酸,硝酸,硫酸,高氯酸的酸性是有差异的,可是在水溶液中无法区分酸性差异,其原因在于水溶液本身具有碱性,其溶剂化作用(质子在溶液中不是单独存在,而是结合溶剂分子生成溶剂合质子,这称为溶剂化作用)导致这四种酸在水溶液中的电离平衡趋势相同,从而无法断定酸性强弱,这类溶剂称为拉平溶剂。反之,若将这四种酸分别放入冰醋酸中,测得的平衡常数是不同的,即电离平衡趋势不同,这类溶剂称之为区分溶剂。据此回答问题:区分溶剂之所以能够区分不同强酸的酸碱性,原因在于其溶剂化作用
_______(填“较强”或“较弱”)。


 (←这只也是咪唑)
(←这只也是咪唑)
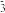 +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O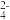 +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH- 2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号)
2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 2NO2(g) △H>0
2NO2(g) △H>0
 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol





 p1=aPa
p1=aPa p2=bPa
p2=bPa
 )>c(H2C2O4)
)>c(H2C2O4) )-c(H2C2O4)]
)-c(H2C2O4)] )>c(C2O
)>c(C2O )]
)] )+c(C2O
)+c(C2O )
) ,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用
,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用

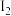

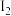 、
、 可知,气态
可知,气态 再失去一个电子则要比气态
再失去一个电子则要比气态 再失去一个电子
再失去一个电子 H3O++OH-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N2O4中发生自耦电离N2O4
H3O++OH-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N2O4中发生自耦电离N2O4 NO++NO
NO++NO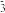 ,此时NO+即为该溶液的酸,NO
,此时NO+即为该溶液的酸,NO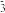 即为该溶液的碱。
即为该溶液的碱。 ,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。
,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。 2H++SO
2H++SO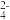 ,因此 H2SO4 与 SO
,因此 H2SO4 与 SO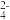 互为共轭酸碱对
互为共轭酸碱对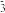 的酸性较弱
的酸性较弱 来判断的。
来判断的。  越大则证明电离程度越大,故酸性越强。
越大则证明电离程度越大,故酸性越强。 H++A-,其中
H++A-,其中 ,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。
,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。

 2H2(g)+S2(g) △H,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) △H,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。