对实验过程中遇到的一些异常现象进行分析能培养我们严谨的科学思维。
【实验一】
某学习小组同学向滴有酚酞的氢氧化钠溶液中加入一定量稀盐酸(如右图),搅拌后烧杯中溶液由红色变为无色。写出反应的化学方程式
______。

【实验目的】判断反应后烧杯中无色溶液(溶液A)的溶质成分。
【实验过程】甲、乙同学分别进行如下实验:
| 实验操作 | 实验现象 | 实验结论 |
| 甲 | 从烧杯中取少量溶液(约1mL)于一支试管中,加入1滴氢氧化钠溶液,振荡 | 溶液变红 | 溶液A呈中性,溶质为NaCl |
| 乙 | 直接向烧杯中加入1滴氢氧化钠溶液,振荡 | 溶液仍为无色 | 溶液A呈酸性,溶质为____________ |
【发现问题】甲、乙同学现象有差异
〖继续探究〗
丙同学向烧杯中加入打磨过的镁条,观察到有气泡产生,则
_______(填“甲”或“乙”)同学的结论正确。
丁同学提出:还可以用“加入AgNO
3溶液,观察有无白色沉淀产生”的方法验证盐酸是否存在。大家一致认为该方案不可行,理由是
______。
〖实验反思〗造成甲、乙同学现象有差异的原因是:乙同学的实验烧杯中残留的盐酸较多,1滴氢氧化钠溶液不足以将盐酸完全反应,故溶液仍为无色,而甲同学
_______。
【实验二】
向氢氧化钠溶液中滴加酚酞,溶液变红,放置一段时间后红色消失,溶液褪为无色。
【提出问题】红色消失的原因是什么?
〖提出猜想〗
猜想1:酚酞与空气中的O
2发生了反应;
猜想2:NaOH与空气中的CO
2发生了反应;
NaOH与CO
2反应的化学方程式为
____。
经讨论后,大家认为猜想2一定不正确,理由是即便NaOH变质了,
______。
〖实验验证〗
| 实验操作 | 实验现象 | 实验结论 |
| 取少量实验中的NaOH溶液于试管中, 再加热煮沸。待上述溶液冷却后,滴入酚酞溶液,再滴入少量植物油 | 溶液变红,一段时间后红色消失。 | 猜想1____(填“正确”或“不正确”) |
实验操作中,将NaOH溶液加热煮沸的目的
_____。
【查阅资料】酚酞的变色范围:pH<8.2时无色;pH等于8.2

10时红色;pH>10时无色。
〖继续探究〗溶液红色消失,可能和NaOH溶液的浓度有关。
备选试剂:①号NaOH溶液(质量分数1%, pH约为13.4)
②号NaOH溶液(质量分数0.01%,pH约为11.4)
③号NaOH溶液(质量分数0.0001%,pH约为9.4)
取等体积
_____(选填①②③)于两支试管中,分别滴加等量酚酞试液。观察到其中一支试管中溶液变红,一段时间后红色消失;另一支试管中
_____。
〖实验结论〗滴有酚酞的NaOH溶液由红色褪为无色与NaOH溶液的浓度有关。
【学以致用】
为测定一瓶氢氧化钠溶液的质量分数,小芳同学进行了如下图所示实验。当溶液颜色由红色恰好变为无色时,消耗稀盐酸7.3g。用该方案测得的氢氧化钠溶液质量分数偏小。结合酚酞的变色范围分析,测量结果偏小的原因是
______。





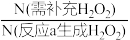 ≥
≥ )在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用。某化学研究性学习小组设计并完成了如下实验。
)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用。某化学研究性学习小组设计并完成了如下实验。

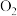 的体积即可测定样品的纯度。
的体积即可测定样品的纯度。 )。某化学研究小组对“鱼浮灵”的制备、成分测定及增氧原理进行了如下探究。
)。某化学研究小组对“鱼浮灵”的制备、成分测定及增氧原理进行了如下探究。 和
和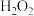 的双重性质;50℃开始分解。
的双重性质;50℃开始分解。 与稳定剂的混合溶液和30%的
与稳定剂的混合溶液和30%的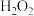 溶液反应制备过氧碳酸钠,实验装置如图所示。
溶液反应制备过氧碳酸钠,实验装置如图所示。
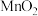 粉末,用带火星的木条伸入试管内
粉末,用带火星的木条伸入试管内
 ,溶液,过滤、洗涤、干燥,得到碳酸钡(
,溶液,过滤、洗涤、干燥,得到碳酸钡( )固体3.94g。
)固体3.94g。 的质量为1.896g,该反应的原理是:
的质量为1.896g,该反应的原理是: 。
。 )的化学式
)的化学式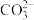 、
、 对
对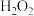 分解速率的影响,设计了对比实验,实验数据记录如下表。
分解速率的影响,设计了对比实验,实验数据记录如下表。
 溶液
溶液 固体
固体 溶液
溶液 溶液
溶液 溶液
溶液 溶液
溶液 溶液
溶液 )
)
 10时红色;pH>10时无色。
10时红色;pH>10时无色。




 CuSO4+SO2↑+2H2O。方案Ⅰ优于方案Ⅱ的理由是
CuSO4+SO2↑+2H2O。方案Ⅰ优于方案Ⅱ的理由是