 CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
 填字母
填字母 。
。 ,则Q点H2的转化率为
,则Q点H2的转化率为 CO2(g)+H2S(g) ΔH<0。某温度时,用活性α—Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[
CO2(g)+H2S(g) ΔH<0。某温度时,用活性α—Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[ ]的转化关系如图甲所示。其他条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图乙所示:
]的转化关系如图甲所示。其他条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图乙所示:

 ]=
]=
 ;
; ,
, Ag+Fe3+的平衡常数K。
Ag+Fe3+的平衡常数K。 AgSCN,K=1012
AgSCN,K=1012 FeSCN2+,K=102.3
FeSCN2+,K=102.3 +2RCl=R2SeO3+2Cl-(R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将
+2RCl=R2SeO3+2Cl-(R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将 的还原过程。SeO
的还原过程。SeO 在微电池正极上转化为单质Se。
在微电池正极上转化为单质Se。 。写出Fe3+水解的离子方程式:
。写出Fe3+水解的离子方程式: 去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是
去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是

图1
 的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO
的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO 的去除效果突然迅速减小的原因是
的去除效果突然迅速减小的原因是
 2NH3(g) △H=
2NH3(g) △H= 4NO(g)+6H2O(g) ∆H=-906kJ∙mol−1
4NO(g)+6H2O(g) ∆H=-906kJ∙mol−1 2N2(g)+6H2O(g) ∆H=-126kJ∙mol−1
2N2(g)+6H2O(g) ∆H=-126kJ∙mol−1
 2CO+2H2,同时发生副反应b:CO2+H2
2CO+2H2,同时发生副反应b:CO2+H2 CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=
CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=  CaO(s)+CO2(g)的平衡常数K=1.5mol/L,在此温度下,CO2又有部分分解成CO,即2CO2(g)
CaO(s)+CO2(g)的平衡常数K=1.5mol/L,在此温度下,CO2又有部分分解成CO,即2CO2(g) 2CO(g)+O2(g),若将5molCaCO3装入1L真空容器中,当达到平衡时气体中O2的物质的量分数为20%,则此时CaO的物质的量为
2CO(g)+O2(g),若将5molCaCO3装入1L真空容器中,当达到平衡时气体中O2的物质的量分数为20%,则此时CaO的物质的量为 CH3OCH3(g)+H2O(g)△H经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+
CH3OCH3(g)+H2O(g)△H经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+ 。其速率方程为:v正=k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、K逆为速率常数,且影响外因只有温度。
。其速率方程为:v正=k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、K逆为速率常数,且影响外因只有温度。 B.
B. C.
C. D.无法确定
D.无法确定 A.常温下,氨水与硫酸混合后,溶液的pH=7:c(NH )>c(SO )>c(SO ) ) |
B.0.1 mol·L-1的NaHCO3溶液中:c(OH-)+c(HCO )+c(CO )+c(CO )=c(H+)+c(Na+) )=c(H+)+c(Na+) |
C.0.1 mol·L-1 HCl溶液与0.2 mol·L-1氨水等体积混合:2c(H+)+c(NH3·H2O)=c(NH )+2c(OH-) )+2c(OH-) |
| D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |

| A.以上反应中属于氧化还原反应的有①②③④ |
B.E与C反应的离子方程式为 |
| C.加热5.00 g D和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31 g,则原混合物中D的质量为4.16 g |
D.将x mol B和y mol E在密闭容器中加热到250℃,让其充分反应,当剩余固体为 、NaOH,排出气体为 、NaOH,排出气体为 、 、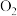 时,x/y的值可能是0.5 时,x/y的值可能是0.5 |
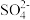 )的负对数pX[pX=-lgc(
)的负对数pX[pX=-lgc(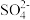 )]与Ba(OH)2溶液体积的关系如图所示。已知:常温下,Ksp(BaSO4)=1.0×10-10。下列说法正确的是
)]与Ba(OH)2溶液体积的关系如图所示。已知:常温下,Ksp(BaSO4)=1.0×10-10。下列说法正确的是
| A.在b、c、d点中,c点对应的c(Fe2+)最小 |
| B.在b、c、d点中,d点对应的水的电离程度最大 |
| C.图中m=5,c点溶液的pH>7 |
D.b点溶液中:c( )>2c( )>2c(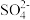 ) ) |
 在电流作用下能转化为
在电流作用下能转化为 ,在不同的催化剂作用下的部分转化路径如下图所示。下列说法
,在不同的催化剂作用下的部分转化路径如下图所示。下列说法
| A.第②⑤步反应属于加成反应 |
| B.第①④⑥步反应需要电源提供电子 |
C.两种转化路径中原子均 转化为产物 转化为产物 |
D.总反应可表示为: |



 =
= 为amol,CO为bmol,反应①的平衡常数为
为amol,CO为bmol,反应①的平衡常数为
 在Ⅰ、Ⅱ两种不同催化剂作用下建立平衡过程中,
在Ⅰ、Ⅱ两种不同催化剂作用下建立平衡过程中, 的转化率[
的转化率[ ]随时间(t)的变化曲线如图。活化能:过程Ⅰ
]随时间(t)的变化曲线如图。活化能:过程Ⅰ
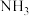 和1mol
和1mol ,6min时达到平衡,测得容器中尿素的物质的量为0.4mol,0-2min内尿素的物质的量随时间的变化趋势如图所示。若反应时间达到2min时,迅速将体系升温(仅发生上述反应),请在图中画出2-8min内容器中尿素的物质的量随时间的变化趋势曲线。
,6min时达到平衡,测得容器中尿素的物质的量为0.4mol,0-2min内尿素的物质的量随时间的变化趋势如图所示。若反应时间达到2min时,迅速将体系升温(仅发生上述反应),请在图中画出2-8min内容器中尿素的物质的量随时间的变化趋势曲线。
 H2R+
H2R+ HR
HR R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)=
R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)= ,下列表述
,下列表述
A. > > |
| B.M点,c(Cl-)+c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+) |
C.O点,pH= |
| D.P点,c(Na+)>c(Cl-)>c(H+)>c(OH-) |