

 对人类社会发展具有重要意义。
对人类社会发展具有重要意义。 可用于人工合成淀粉,共需要11步,其中前两步涉及的反应如图1所示。
可用于人工合成淀粉,共需要11步,其中前两步涉及的反应如图1所示。

 的
的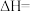
 、
、 、
、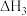 和
和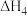 表示)
表示) ,该反应一般认为分两步完成,反应过程中能量变化示意图如图2所示:
,该反应一般认为分两步完成,反应过程中能量变化示意图如图2所示:
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如上图3、图4所示。
的平衡产率随温度的变化关系如上图3、图4所示。
 的平衡产率
的平衡产率
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温,高压的反应条件
的平衡产率,应选择低温,高压的反应条件 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向 。实验测得:
。实验测得: ,
, ,
, 、
、 为速率常数。
为速率常数。 温度下,向
温度下,向 恒容密闭容器中加入
恒容密闭容器中加入 ,起始压强为
,起始压强为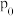 ,
, 时该反应达到平衡。此时测得
时该反应达到平衡。此时测得 的体积分数为
的体积分数为 ,则平衡时
,则平衡时 的转化率
的转化率
 时,
时, ,则
,则
 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。 高效转化为乙烯、乙醇、甲酸、乙酸等有机物,如下图5所示。
高效转化为乙烯、乙醇、甲酸、乙酸等有机物,如下图5所示。
 、
、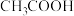 的混合溶液。测得此溶液
的混合溶液。测得此溶液 ,
,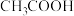 浓度为
浓度为 ,估算
,估算 浓度为
浓度为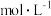 。已知
。已知 ,
, 。
。 与E存在如下关系:
与E存在如下关系: ,其中n表示在电池中发生单位反应(电池反应对应的计量系数为最简整数比)时转移电子的物质的量,F为法拉第常数,可取
,其中n表示在电池中发生单位反应(电池反应对应的计量系数为最简整数比)时转移电子的物质的量,F为法拉第常数,可取 。该电解池所用电池为
。该电解池所用电池为 电池,电池仅由
电池,电池仅由 与
与 反应,得到
反应,得到 与另一种固体单质,反应的
与另一种固体单质,反应的 ,则电池电动势
,则电池电动势
| A.在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- |
| B.在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ |
| C.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ |
| D.在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 |
| I1 | I2 | I3 | I4 | |
| 电离能/kJ·mol-1 | 633 | 1235 | 2389 | 7019 |
 2CeO2+2CO2+4CO
2CeO2+2CO2+4CO O,则其分子中σ键的数目是
O,则其分子中σ键的数目是 nm和
nm和


A.向NH4HA溶液中滴加少量NaOH溶液到m点的过程中,HA-反应的比例小于NH |
| B.f点时,溶液中c(A2- )+c(HA- )+c(OH- )=c(Na+ )+c(H+ ) |
C. = 10-3 = 10-3 |
D.在d、n点溶液中均满足c(H2A)+c(HA- )+c(A2- )=c(NH3·H2O)+c(NH )=0.1mol·L-1 )=0.1mol·L-1 |

 催化重整为可用的化学品,对改善环境意义重大。
催化重整为可用的化学品,对改善环境意义重大。 的刚性容器中进行“合成气催化重整”,反应的化学方程式为
的刚性容器中进行“合成气催化重整”,反应的化学方程式为 。当投料比,
。当投料比, 时,
时, 的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。压强
的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。压强
 ;当温度为
;当温度为 、压强为
、压强为 时,a点时的v(逆)
时,a点时的v(逆) 密闭容器中,充入不同
密闭容器中,充入不同 ,的原料气体,控制温度700℃,发生反应
,的原料气体,控制温度700℃,发生反应 ,请在如图中画出
,请在如图中画出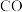 在混合气体中的平衡体积分数随
在混合气体中的平衡体积分数随 递增的变化趋势。
递增的变化趋势。
 合成甲醇是
合成甲醇是 资源化利用的重要方法。研究表明在催化剂作用下
资源化利用的重要方法。研究表明在催化剂作用下 和
和 可发生反应:
可发生反应:
 和
和 合成甲醇时,
合成甲醇时, 的平衡转化率如图1所示。已知温度
的平衡转化率如图1所示。已知温度 ,则该反应自发进行的条件是
,则该反应自发进行的条件是
 恒容密闭容器中充入和
恒容密闭容器中充入和 的混合气体
的混合气体 ,此时容器内压强为4p,两种气体的平衡转化率α与起始时
,此时容器内压强为4p,两种气体的平衡转化率α与起始时 的关系如图2所示。图2中
的关系如图2所示。图2中 的平衡转化率与
的平衡转化率与 的关系可用曲线
的关系可用曲线 ”或“
”或“ ”)表示。该温度下,此反应的平衡常数
”)表示。该温度下,此反应的平衡常数

 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
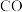 和
和 ,其中相对较多的副产物为
,其中相对较多的副产物为 B.
B.
 D.
D.
 向
向
 和
和 应用前景广泛,对其制备过程的研究成为热点。回答下列问题:
应用前景广泛,对其制备过程的研究成为热点。回答下列问题: 下用镓与氨气制得氮化镓,该可逆反应每生成
下用镓与氨气制得氮化镓,该可逆反应每生成 放出
放出 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是 ,沸点是
,沸点是 ;氮化镓的熔点为
;氮化镓的熔点为 )。
)。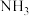 的体积分数与压强(P)、温度(T)的关系如图1所示(已知图中
的体积分数与压强(P)、温度(T)的关系如图1所示(已知图中 和
和 的温度均小于
的温度均小于 )。
)。
 时达到了化学平衡状态
时达到了化学平衡状态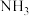 的转化率减小
的转化率减小
 的晶体结构如图2所示,
的晶体结构如图2所示, 原子和N原子都是
原子和N原子都是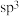 杂化
杂化 时体系的初始压强为
时体系的初始压强为 ,则A点的
,则A点的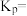
 ),分压=总压×气体的物质的量分数,用含a的式子表示]。
),分压=总压×气体的物质的量分数,用含a的式子表示]。 ,导致电解效率下降。若外电路通过
,导致电解效率下降。若外电路通过 电子时,阴极得到
电子时,阴极得到 的镓。则该电解装置的电解效率
的镓。则该电解装置的电解效率
 )。
)。 在一定温度下可直接生成
在一定温度下可直接生成 ,加入少量
,加入少量 固体可促进反应。将等质量的铅粉与不同量的
固体可促进反应。将等质量的铅粉与不同量的 混合均匀后置于充满
混合均匀后置于充满 的密闭容器中,用电火花引燃。不同温度下合成产物的
的密闭容器中,用电火花引燃。不同温度下合成产物的 图谱如图3所示,产品中
图谱如图3所示,产品中 的质量分数
的质量分数 随原料中
随原料中 的变化如图4所示,燃烧过程中温度随时间的变化如图5所示。则:
的变化如图4所示,燃烧过程中温度随时间的变化如图5所示。则:
 的最佳条件是
的最佳条件是 较小时,有利于
较小时,有利于 制备的原因可能是
制备的原因可能是 超过一定值后,
超过一定值后, 明显减少的原因可能是
明显减少的原因可能是
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

 VO2++H2O+V3+,电池充电时阳极的电极反应式为
VO2++H2O+V3+,电池充电时阳极的电极反应式为 CH3OH(g) △H。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图所示。
CH3OH(g) △H。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图所示。


 N2(g)+CO2(g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
 H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
