 ,可作为
,可作为 捕获剂的有
捕获剂的有 溶液 b.氨水 c.
溶液 b.氨水 c. 溶液
溶液 催化剂,将
催化剂,将 与
与 合成
合成 ,主要反应的热化学方程式如下。
,主要反应的热化学方程式如下。


 ×100%
×100% 制取甲醇的反应装置如图所示:电极a接电源
制取甲醇的反应装置如图所示:电极a接电源
 可催化加氢生成
可催化加氢生成 ,其过程为:向
,其过程为:向 溶液中通入
溶液中通入 转化为
转化为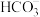 ,一定条件下再通入
,一定条件下再通入 可反应生成
可反应生成 ,进一步生产
,进一步生产 。
。 产率
产率 曲线见图。当温度高于
曲线见图。当温度高于 时,
时, 的产率下降,可能的原因是
的产率下降,可能的原因是
 、Fe2+、Al3+、Cl-、SO
、Fe2+、Al3+、Cl-、SO 、CO
、CO 、AlO
、AlO 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:下列说法正确的是
中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:下列说法正确的是
A.无法确定原试液中是否含有SO |
B.滤液X中大量存在的阳离子有NH 、Fe2+和Ba2+ 、Fe2+和Ba2+ |
| C.沉淀C为Al(OH)3 |
| D.原试液中一定不含有K+ |




 100%。
100%。
 =2798
=2798 。则
。则 =
=


 )。下列表述错误的是
)。下列表述错误的是
| A.z点后存在某点,溶液中的水的电离程度和y点的相同 |
| B.a约为3.5 |
C.z点处, |
D.x点处的溶液中离子满足: |
 和
和 制备燃料合成器,计算机模拟单个二氧化碳分子与甲烷分子的反应历程如图所示:
制备燃料合成器,计算机模拟单个二氧化碳分子与甲烷分子的反应历程如图所示:
 )经过1伏特的电位差加速后所获得的动能。
)经过1伏特的电位差加速后所获得的动能。 总反应的热化学方程式为
总反应的热化学方程式为 和
和 ,测得平衡时压强对数
,测得平衡时压强对数 和
和 的关系如图所示。(压强的单位为:MPa)
的关系如图所示。(压强的单位为:MPa)

 。
。



A.每断裂 键,同时生成 键,同时生成 键 键 |
| B.容器内温度不再变化 |
| C.混合气体的密度不再变化 |
D. |
 条件下,按起始投料
条件下,按起始投料 ,匀速通入反应器中在不同温度下反应相同时间,测得丙烷和氧气的转化率如下图。
,匀速通入反应器中在不同温度下反应相同时间,测得丙烷和氧气的转化率如下图。
 ”或“
”或“ ”)表示丙烷的转化率。
”)表示丙烷的转化率。 后曲线
后曲线 随温度升高而降低的原因为
随温度升高而降低的原因为 ”或“
”或“ ”)时,可判断反应ii不再发生。
”)时,可判断反应ii不再发生。 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 。
。 的溶液,则溶液中
的溶液,则溶液中
 、
、 )。
)。 固体,每次用
固体,每次用 溶液处理,若使
溶液处理,若使 中的
中的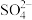 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理 、
、 )
) 
 ]历程,该反应经历的Ⅰ、Ⅱ、Ⅲ三个过渡态分别对应阶段①、阶段②、阶段③。图中显示的是反应过程中每一阶段内各驻点的能量相对于此阶段内反应物能量的差值(图中标出的物质均为气态)。
]历程,该反应经历的Ⅰ、Ⅱ、Ⅲ三个过渡态分别对应阶段①、阶段②、阶段③。图中显示的是反应过程中每一阶段内各驻点的能量相对于此阶段内反应物能量的差值(图中标出的物质均为气态)。
 的投料比将NO(g)与CO(g)充入体积可变的恒压密闭容器中,在一定条件下发生反应
的投料比将NO(g)与CO(g)充入体积可变的恒压密闭容器中,在一定条件下发生反应 ,用NO表示的正反应速率为
,用NO表示的正反应速率为 ,用
,用 表示的逆反应速率为
表示的逆反应速率为 (
( 、
、 表示速率常数且只与温度有关),NO(g)的平衡转化率与温度、压强的关系如图所示。
表示速率常数且只与温度有关),NO(g)的平衡转化率与温度、压强的关系如图所示。
 、
、 、
、 由大到小的顺序是
由大到小的顺序是 由小到大的顺序是
由小到大的顺序是 ℃、压强为
℃、压强为 时,向VL容器中充入2.0molNO(g)和2.0molCO(g)发生上述反应,5min后反应达到平衡(X点),该温度下的浓度平衡常数
时,向VL容器中充入2.0molNO(g)和2.0molCO(g)发生上述反应,5min后反应达到平衡(X点),该温度下的浓度平衡常数


 溶液中含磷物种的浓度之和为0.1
溶液中含磷物种的浓度之和为0.1 ,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(
,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数( ),pOH表示OH的浓度的负对数[
),pOH表示OH的浓度的负对数[ ]。下列有关说法正确的是
]。下列有关说法正确的是
A.曲线①表示pc( )随pOH的变化 )随pOH的变化 |
B.b点时, |
C.d点溶液中: |
D. 溶液呈碱性是因为 溶液呈碱性是因为 离子的水解程度大于其电离程度 离子的水解程度大于其电离程度 |
 和
和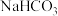 混合物中
混合物中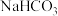 的含量,称取
的含量,称取 样品,溶于水配成
样品,溶于水配成 溶液,取出该溶液
溶液,取出该溶液 用
用 盐酸滴定,得到图曲线.下列说法不正确的是
盐酸滴定,得到图曲线.下列说法不正确的是

A.此样品 |
B.计量点 溶液中大量存在的阴离子是 溶液中大量存在的阴离子是 |
C.计量点 之间发生反应的离子方程式为 之间发生反应的离子方程式为 |
D.使用该方法测定 和NaOH混合溶液中的NaOH含量,将会得到1个计量点 和NaOH混合溶液中的NaOH含量,将会得到1个计量点 |
 、
、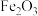 和不溶性杂质)为原料制备NiOOH的过程可表示为:
和不溶性杂质)为原料制备NiOOH的过程可表示为:
 外还有少量的
外还有少量的 和
和 等,下列说法错误的是
等,下列说法错误的是A.氧化性: |
| B.除杂过程仅为过滤操作 |
C.氧化过程中每生成1mol NiOOH消耗 |
D.工业上也可电解碱性 悬浊液制备NiOOH,加入一定量的KCl有助于提高生产效率 悬浊液制备NiOOH,加入一定量的KCl有助于提高生产效率 |
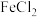 、
、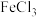 、
、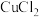 的工业废液中回收铜并制备氯化铁晶体的流程如下,则下列说法不正确的是
的工业废液中回收铜并制备氯化铁晶体的流程如下,则下列说法不正确的是
| A.试剂a为铁,试剂b为稀硫酸 |
B.加入试剂a过程中,有红色固体析出后,说明溶液中 已经反应完全 已经反应完全 |
C.试剂c可为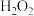 溶液,相应的反应为 溶液,相应的反应为 |
| D.溶液W可作“腐蚀液”腐蚀覆铜板 |