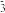 在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
| A.反应进行一段时间后速率下降可能是因为c(OH-)的浓度下降导致。 |
| B.纵坐标为v(H+)的v-t曲线在通过平移后可与图中图象完全重合。 |
C.图中阴影部分的面积表示t1~t2时间内ClO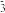 的物质的量的减少量。 的物质的量的减少量。 |
| D.系数为最简整数比时,每摩尔反应转移6mol e-并产生3mol质子。 |
 的整数倍(类似任何物体的电荷数都是元电荷的整数倍):
的整数倍(类似任何物体的电荷数都是元电荷的整数倍):
 为普朗克常量,
为普朗克常量, 为电磁波频率(注:在工程学上电磁波频率用
为电磁波频率(注:在工程学上电磁波频率用 表示,二者通用)
表示,二者通用) 的光,其也存在最小能量
的光,其也存在最小能量 ,我们称之为“光子”
,我们称之为“光子” )向能量较低的轨道(能量记为
)向能量较低的轨道(能量记为 )跃迁时,会释放出能量为
)跃迁时,会释放出能量为 的光子。其能量由前后两个能级的能量差决定:
的光子。其能量由前后两个能级的能量差决定:
 ),波长记为
),波长记为 ,频率记为
,频率记为 ,满足
,满足  。
。 三种跃迁时,释放光子的波长分别是
三种跃迁时,释放光子的波长分别是 ,则下列说法正确的是(横线表示一个能级。右侧数值表示该能级下氢原子具有的能量,单位为 eV (电子伏特),能量单位。箭头表示从一个能级跃迁到另一个能级)。下列说法错误的是
,则下列说法正确的是(横线表示一个能级。右侧数值表示该能级下氢原子具有的能量,单位为 eV (电子伏特),能量单位。箭头表示从一个能级跃迁到另一个能级)。下列说法错误的是
A.发生 跃迁时,释放光子的波长可表示为 跃迁时,释放光子的波长可表示为 |
B.发生 跃迁时,氢原子能量增加 跃迁时,氢原子能量增加 |
C.用12.09 的光子照射大量处于基态的氢原子时,一个氢原子可辐射出3种频率的光 的光子照射大量处于基态的氢原子时,一个氢原子可辐射出3种频率的光 |
D.大量处于 能级的氢原子向低能级跃迁时,可能辐射出3种频率的光 能级的氢原子向低能级跃迁时,可能辐射出3种频率的光 |


 CO2(g)+H2(g) △H<0,装置如图。
CO2(g)+H2(g) △H<0,装置如图。
 2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高 NH
NH +NH
+NH K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH
K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH )=
)= (电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
(电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式 C2H4(g)+2HI(g) ΔH1
C2H4(g)+2HI(g) ΔH1 2C3H6(g) ΔH2
2C3H6(g) ΔH2 C4H8(g) ΔH3(298K)
C4H8(g) ΔH3(298K)
A.298K时,反应3CH3I(g) C3H6(g)+3HI(g) ΔH=-66.3kJ•mol-1 C3H6(g)+3HI(g) ΔH=-66.3kJ•mol-1 |
| B.图中曲线X表示乙烯的物质的量分数随温度的变化 |
| C.A、B是曲线Y上两点,曲线Y对应反应的平衡转化率:α(A)<α(B) |
| D.当平衡体系温度从600K升高到800K时,三条曲线对应的反应:X和Y正向移动,Z逆向移动 |

 ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
 CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-l
CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-l CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1 p,则0~20min内v(CH4)=
p,则0~20min内v(CH4)= ,计算保留三位有效数字)。
,计算保留三位有效数字)。
 C3H6(g)+3H2O(g);
C3H6(g)+3H2O(g); C2H4(g)+2H2O(g)
C2H4(g)+2H2O(g) (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
 ,各容器中起始物质的量浓度与反应温度(已知
,各容器中起始物质的量浓度与反应温度(已知 )如表所示:
)如表所示:| 容器 | 温度/℃ | 起始物质的量浓度 | |||
 |  |  |  | ||
| 甲 |  | 0.10 | 0.10 | 0 | 0 |
| 乙 |  | 0 | 0 | 0.10 | 0.20 |
| 丙 |  | 0.10 | 0.10 | 0 | 0 |
 的物质的量随时间变化关系如图所示。下列说法不正确的是
的物质的量随时间变化关系如图所示。下列说法不正确的是
A.该反应的正反应为放热反应,平衡常数 |
| B.达到平衡时,乙容器中的压强一定小于甲容器的2倍 |
C.乙容器中反应达到平衡时, 的转化率大于40% 的转化率大于40% |
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol  ,此时v(正)>v(逆) ,此时v(正)>v(逆) |
 最大使用量为
最大使用量为 ,取
,取 葡萄酒。通过适当的方法使其所含
葡萄酒。通过适当的方法使其所含 全部逸出并用
全部逸出并用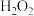 将其全部氧化为
将其全部氧化为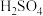 ,这样得到
,这样得到 溶液。然后用
溶液。然后用 标准溶液进行滴定。
标准溶液进行滴定。 溶液润洗滴定管
溶液润洗滴定管 次;
次; 溶液注入滴定管至刻度“0”以上
溶液注入滴定管至刻度“0”以上 处;
处; 待测硫酸溶液注入洁净的锥形瓶中,并加入
待测硫酸溶液注入洁净的锥形瓶中,并加入 滴指示剂;
滴指示剂; 溶液滴定至终点并记下读数。
溶液滴定至终点并记下读数。| 实验 | 消耗 溶液的体积 溶液的体积 | 待测酸的体积 |
| 1 | 21.60 | 20.00 |
| 2 | 21.70 | 20.00 |
| 3 | 25.60 | 20.00 |
 (保留4位小数)。经计算,该葡萄酒中
(保留4位小数)。经计算,该葡萄酒中 使用量为
使用量为 (保留3位小数),由此可以判断其是否达标。
(保留3位小数),由此可以判断其是否达标。 固体(含少量
固体(含少量 杂质)配制标准溶液并用来滴定,则对滴定结果产生的影响是
杂质)配制标准溶液并用来滴定,则对滴定结果产生的影响是 、
、 、
、 、
、 、
、 、
、 、
、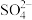 )中回收氧化铁的流程如图所示:
)中回收氧化铁的流程如图所示:
 、
、 ;
;  、
、 。
。 的溶液中
的溶液中 存在的最大浓度为
存在的最大浓度为 ,在
,在 时将
时将 沉淀出来,写出反应的离子方程式:
沉淀出来,写出反应的离子方程式: 、
、 等又是环境污染的主要物质,研究其转化规律一直是科学热点问题。根据所学知识回答下列问题:
等又是环境污染的主要物质,研究其转化规律一直是科学热点问题。根据所学知识回答下列问题:




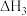
 的
的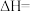
 是乙二胺四乙酸根离子,与
是乙二胺四乙酸根离子,与 形成的络合物
形成的络合物 可用于吸收烟气中的
可用于吸收烟气中的 。其吸收原理:
。其吸收原理:
 。将含
。将含 的烟气以一定的流速通入起始温度为50℃的
的烟气以一定的流速通入起始温度为50℃的 溶液中。
溶液中。 吸收率随通入烟气的时间的变化如图所示。时间越长,
吸收率随通入烟气的时间的变化如图所示。时间越长, 吸收率越低的原因是
吸收率越低的原因是
 可直接催化分解:
可直接催化分解: ,同时伴有副反应
,同时伴有副反应
 发生。
发生。 时,将含
时,将含 的混合气体(
的混合气体( 体积分数为40%)以
体积分数为40%)以 的流速通过催化剂,测得
的流速通过催化剂,测得 的转化率为40%,则平均反应速率
的转化率为40%,则平均反应速率 为
为 。欲提高
。欲提高 的转化率,可采取的措施为
的转化率,可采取的措施为 和
和 时,在恒压密闭容器中进行模拟实验。各组分(
时,在恒压密闭容器中进行模拟实验。各组分( 含量极少,可忽略)的相关信息如表:
含量极少,可忽略)的相关信息如表:物质 |
|
|
|
|
|
|
n(投料)/mol | 19 | 34 | 6.5 | 25 | 0 | 0 |
n(平衡)/mol | 50 | x | 20 | 25 | 2 | 2 |

 的平衡转化率为
的平衡转化率为 的压强平衡常数
的压强平衡常数
 (用分压表示,
(用分压表示, )。
)。  CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1 H2O(g)+CO(g) △H2=+41kJ·mol-1
H2O(g)+CO(g) △H2=+41kJ·mol-1
| A.a、b、c三点H2转化率:c>a>b |
| B.上述三种温度之间关系为T1>T2>T3 |
| C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大 |
| D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动 |
 的变化曲线如下图。
的变化曲线如下图。
 =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为
 ”“
”“ ”或“
”或“ ”)。
”)。