
| A.b点溶液中:c(OH-)=1×10-7 mol·L-1 |
| B.a点溶液中:水电离出的c(H+)=1×10-10 mol·L-1 |
C.c点溶液中:c(Na+)>c(CO )>c(HCO )>c(HCO ) ) |
| D.d点溶液中:溶液是NaHCO3和H2CO3的混合液 |
 ;
; ;
;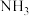 可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与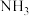 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是| A.氧化产物与还原产物物质的量之比为3:2 |
B.反应中有4.48 L 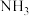 被氧化 被氧化 |
C.转移电子数为1.2 |
D.原混合气体中NO、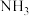 物质的量之比为3:7或4:1 物质的量之比为3:7或4:1 |
 。实验过程如下:
。实验过程如下: 固体(0.0250 mol),配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
固体(0.0250 mol),配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
 标准溶液,备用。
标准溶液,备用。
 溶液,使
溶液,使
 溶液作指示剂。
溶液作指示剂。
 溶液滴定过量的
溶液滴定过量的 。
。| 实验序号 | 1 | 2 | 3 | 4 |
消耗 溶液的体积/mL 溶液的体积/mL | 5.02 | 5.00 | 5.24 | 4.98 |

 固体配制标准溶液时,所使用的
固体配制标准溶液时,所使用的 溶液滴定过量
溶液滴定过量 时,达到滴定终点时的现象是
时,达到滴定终点时的现象是
 。
。 的测定结果偏高的是
的测定结果偏高的是 标准溶液时,烧杯中的溶液有少量溅出
标准溶液时,烧杯中的溶液有少量溅出 溶液的滴定管用水洗净后,没有用
溶液的滴定管用水洗净后,没有用 溶液润洗
溶液润洗 溶液的体积时,滴定前仰视,滴定后俯视
溶液的体积时,滴定前仰视,滴定后俯视 
A.在a点的溶液中,c(H2CO3)-c(CO )> c(OH-)-c(C1-) )> c(OH-)-c(C1-) |
B.在b点的溶液中,2n(H2CO3)+ n(HCO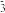 )<0.002 mol )<0.002 mol |
| C.煮沸目的是除去CO2,使突跃变大,冷却后继续滴定到终点 |
| D.若将0.10mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时: c(Na+)=c(CH3COO-) |
 为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。
为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。 溶液和
溶液和 溶液。
溶液。 基态核外电子排布式为
基态核外电子排布式为
| 资料卡片 ⅰ.  ; ; ⅱ.  为9~l1.5条件下 为9~l1.5条件下 和磺基水杨酸 和磺基水杨酸 生成稳定的黄色络合物 生成稳定的黄色络合物 , , 可以通过测定吸光度得知其浓度。 可以通过测定吸光度得知其浓度。 |
 溶液与
溶液与 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化) 浓度测得K。取
浓度测得K。取 滤液,用
滤液,用 标准溶液滴定滤液中
标准溶液滴定滤液中 ,至滴定终点时消耗
,至滴定终点时消耗 标准溶液
标准溶液 。滴定终点的现象为
。滴定终点的现象为 的平衡常数
的平衡常数
 、
、 、V的计算式表示)
、V的计算式表示) 浓度测得K。取
浓度测得K。取 滤液,加入
滤液,加入 磺基水杨酸溶液,加入
磺基水杨酸溶液,加入 为9~11.5的缓冲溶液,测定吸光度。测得溶液中
为9~11.5的缓冲溶液,测定吸光度。测得溶液中 浓度为
浓度为 ,则
,则 的平衡常数
的平衡常数
 溶液和
溶液和 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。| 序号 |  |  |  |  |
| Ⅰ | 10 | 10 |  | |
| Ⅱ | 2 | a | b |  |


 和
和 存在的关系是
存在的关系是 和
和 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。  和
和 使之发生反应
使之发生反应 ,起始时压强为
,起始时压强为 ,平衡时容器内压强为起始时的6/7。计算并回答:
,平衡时容器内压强为起始时的6/7。计算并回答: 表示)计算,分压=总压×物质的量分数,则上述反应的
表示)计算,分压=总压×物质的量分数,则上述反应的
 的代数式表示)。
的代数式表示)。 。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为
。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为 的溶液中滴入等浓度的NaOH溶液,H3A、
的溶液中滴入等浓度的NaOH溶液,H3A、 、
、 、
、 的物质的量分数与溶液的pH的关系如图所示。
的物质的量分数与溶液的pH的关系如图所示。
 的
的 溶液的pH约为
溶液的pH约为 )
) 的平衡常数为K=
的平衡常数为K=A. |
B. |
C. |
D. |
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理: 、
、
 ),发生反应的离子方程式为
),发生反应的离子方程式为 ,则残留的
,则残留的 的浓度为
的浓度为 ,
, )。
)。  的价电子排布式为
的价电子排布式为 中含有的σ键数目为
中含有的σ键数目为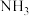 分子与
分子与 形成配合物后
形成配合物后 键角
键角 中配体
中配体 的空间结构为
的空间结构为
 浓度升高对人类生产、生活产生了影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生了影响,碳及其化合物的资源化利用成为研究热点。回答下列问题: 溶于水存在以下过程:
溶于水存在以下过程:


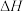
 的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为
的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为 。当大气压强为
。当大气压强为 ,大气中
,大气中 的物质的量分数为x时,溶液中
的物质的量分数为x时,溶液中 的浓度为
的浓度为 (忽略
(忽略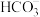 和水的电离)。
和水的电离)。 。
。








 、
、 、
、 的曲线分别是c、
的曲线分别是c、
 ,x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示。根据速率方程分析T>Tm时,v逐渐下降的原因是
,x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示。根据速率方程分析T>Tm时,v逐渐下降的原因是
 同时存在如下反应:
同时存在如下反应:



 的恒压密闭容器中,通入2mol
的恒压密闭容器中,通入2mol 和1mol
和1mol 发生上述反应。平衡时
发生上述反应。平衡时 的分压为
的分压为 ,甲烷的转化率为40%。
,甲烷的转化率为40%。 和
和 不变,说明反应达到平衡状态
不变,说明反应达到平衡状态
 和
和 的计算式表示)。
的计算式表示)。 
| A.“酸1”比“酸2”的酸性弱 |
B.“酸2”的浓度为0.01 |
C.“酸2”的Ka的数量级约为 |
| D.滴定“酸1”和“酸2”均可用甲基橙作指示剂 |