
| A.水的电离程度:M>N=Q>P |
B.图中M、P、Q三点对应溶液中 相等 相等 |
| C.N点溶液中c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-) |
| D.P点溶液中c(OH-)=c(H+)+c(HX-)+c(H2X) |
 C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
| A.c曲线表示的是0.01MPa压强下丙烯随温度变化的物质的量分数 |
| B.A点对应的该反应平衡常数Kp=1.25MPa(Kp为以分压表示的平衡常数) |
| C.B点丙烷的平衡转化率为33.3% |
| D.实际生产过程中需通入一定量水蒸气,其目的是稀释原料气,增大丙烯的平衡产率 |

| A.25℃时,NH3·H2O的电离平衡常数为10-9.25 |
| B.P1所示溶液:c(Cl-)=0.05 mol·L-1 |
| C.P2所示溶液:c(NH3·H2O)>c(OH-)+c(Cl-) |
D.P3所示溶液:c(NH )+c(NH3·H2O)=c(Cl-) )+c(NH3·H2O)=c(Cl-) |
 、SO
、SO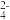 、SO
、SO 、Cl-、Fe2+、Fe3+、CO
、Cl-、Fe2+、Fe3+、CO 中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:
中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:A.无法确定原溶液中是否存在SO |
| B.是否存在Na+需要通过焰色反应来确定 |
C.CO 肯定不存在,Fe2+、Fe3+至少有一种 肯定不存在,Fe2+、Fe3+至少有一种 |
D.溶液中存在NH 、SO 、SO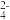 、Cl-、Fe2+ 、Cl-、Fe2+ |


 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)

 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1 CH3OH(g) △H2
CH3OH(g) △H2 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3 CH3OH(g)+H2O(g),测得不同时刻容器内压强变化如表:
CH3OH(g)+H2O(g),测得不同时刻容器内压强变化如表:| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| p/MPa | 80 | 75 | 72 | 71 | 70 | 70 |
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3 CH3OCH3(g)+H2O(g) △H4
CH3OCH3(g)+H2O(g) △H4 )的关系如图所示,则△H4
)的关系如图所示,则△H4

 =1。
=1。
| A.x点溶液中,CH3COOH电离程度小于CH3COONa的水解程度 |
| B.y点溶液中,c(CH3COO-)=c(Na+)>c(H+)= c(OH-) |
| C.w点溶液的碱性强于z点溶液的碱性 |
| D.25℃时,CH3COOH的电离常数Ka=1×10-a |
 )。几种物质的标准摩尔生成焓如下:
)。几种物质的标准摩尔生成焓如下:物质 | CO2(g) | H2O(g) | CH3OH(g) |
| -393.5 | - 241. 8 | - 205. 0 |

 CH3OH(g)+H2O(g) ΔH1<0
CH3OH(g)+H2O(g) ΔH1<0 CO(g) +H2O(g) ΔH2>0
CO(g) +H2O(g) ΔH2>0
 ×100%]的影响如图所示。温度相同时CH3OH选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
×100%]的影响如图所示。温度相同时CH3OH选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
 pkPa。若反应速率用单位时间内分压变化表示,则10min内生成CH3OH的反应速率v(CH3OH)为
pkPa。若反应速率用单位时间内分压变化表示,则10min内生成CH3OH的反应速率v(CH3OH)为 H2(g)+I2(g)进行了大量研究。回答下列问题:
H2(g)+I2(g)进行了大量研究。回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 100 |
| x(HI) | 1 | 0.901 | 0.842 | 0.810 | 0.800 | 0.800 |
 2HBr(g)+I2(g) Kp1
2HBr(g)+I2(g) Kp1 H2(g)+Br2(g) Kp2
H2(g)+Br2(g) Kp2 和lgKp2~
和lgKp2~ 均为线性关系,如图所示:
均为线性关系,如图所示:
 H2(g)+Br2(g)反应的△H
H2(g)+Br2(g)反应的△H H2(g)+I2(g)的K=
H2(g)+I2(g)的K= 2I(g) K
2I(g) K =
=
 2HI(g) K
2HI(g) K
 =
= gG(g)+hH(g)Kθ=
gG(g)+hH(g)Kθ= ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压)。 



| 化学键 | C-C | C=C | C-H | H-H | O-H | C=O | C-O |
键能/ | 356 | 615 | 413 | 436 | 462 | 745 | 360 |
 作载气时,保持总压不变,调控甲醇和
作载气时,保持总压不变,调控甲醇和 的不同分压,各产物的选择性如下表所示(其他产物略):
的不同分压,各产物的选择性如下表所示(其他产物略): 分压/MPa 分压/MPa |  分压/MPa 分压/MPa | 丙烯选择性/% | 乙烯选择性/% |
| 0.10 | 0 | 30.9 | 7.51 |
| 0.08 | 0.02 | 32.0 | 7.42 |
| 0.04 | 0.06 | 34.8 | 7.03 |
| 0.02 | 0.08 | 36.7 | 6.48 |
| 0.01 | 0.09 | 39.4 | 5.43 |
 。温度为500K时,在密闭反应器中加入2mol
。温度为500K时,在密闭反应器中加入2mol  ,若只发生反应Ⅰ,达平衡状态时,体系中
,若只发生反应Ⅰ,达平衡状态时,体系中 的物质的量分数为___________(填序号)。
的物质的量分数为___________(填序号)。A. | B. | C. | D. |
 ,反应达到平衡时压强为
,反应达到平衡时压强为 ,则平衡混合体系中,丙烯的体积分数为
,则平衡混合体系中,丙烯的体积分数为 、
、 的式子表示,下同),若平衡时甲醇的转化率为60%,则反应II(OTP)的平衡常数
的式子表示,下同),若平衡时甲醇的转化率为60%,则反应II(OTP)的平衡常数
 △H,同时也会有芳香烃等副产品,其中丙烯和芳香烃选择性与不同温度下反应I进行的程度的关系如图所示。要提高丙烯的选择性,可采取的措施是
△H,同时也会有芳香烃等副产品,其中丙烯和芳香烃选择性与不同温度下反应I进行的程度的关系如图所示。要提高丙烯的选择性,可采取的措施是