| A.等质量的CO和CO2中,氧元素的质量比为11:14 |
| B.人尿中含2%的尿素[CO(NH2)2],则人尿中氮元素的质量分数为0.6% |
| C.将8 gFe片浸入CuSO4溶液中,取出干燥后称得固体质量为8.4 g,则参加反应的Fe的质量为0.35 g |
| D.某Na2CO3和Na2SO4的混合物加入足量BaCl2溶液得沉淀43 g,在沉淀中加入足量稀硫酸,固体质量变为46.6 g,则原混合物中Na2SO4的质量分数约为57.3% |
| A.样品中一定只含有Mg |
| B.样品中一定不含有Fe,可能含有Ag |
| C.稀硫酸的溶质质量分数为9.8% |
| D.无色溶液中溶质总质量为24g |
| A.5:4 | B.1:1 | C.5:6 | D.5:9 |
 2FeCl2+ C6H4Cl2(液体)+HCl(气体),制取无水FeCl2。反应装置如图所示。
2FeCl2+ C6H4Cl2(液体)+HCl(气体),制取无水FeCl2。反应装置如图所示。

| 物质 | Ca(OH)2 | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 0.16 | 109 | 21.8 | 9.6 |


A. | B. | C. | D. |
 ,某校化学兴趣小组拟用该反应制取并收集两瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染室气,设计了如下装置。
,某校化学兴趣小组拟用该反应制取并收集两瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染室气,设计了如下装置。
| A.氢氧化钠溶液 | B.浓硫酸 |

 :
: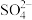 :M=1:1:3:2,则M为
:M=1:1:3:2,则M为| A.Cu2+ | B.Na+ | C.C1- | D.Mg2+ |
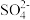 、Cl-和
、Cl-和 离子中的一种或者几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入Ba(OH)2溶液的质量与产生沉淀的质量关系如图,下列有关说法正确的是
离子中的一种或者几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入Ba(OH)2溶液的质量与产生沉淀的质量关系如图,下列有关说法正确的是 
| A.b点对应溶液中一定含有的溶质是BaCl2、NaCl |
| B.ab段产生的沉淀是Mg(OH)2、BaCO3 |
C.溶液中一定含有H+、Mg2+、Cl-,一定不含有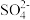 、 、 ,可能含有Na+ ,可能含有Na+ |
D.溶液中一定含有H+、Na+、Cl-,一定不含有 ,可能含有 Mg2+、 ,可能含有 Mg2+、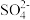 |
| A.如果该合金为铁和镁,则m可能是0.3g |
| B.反应后溶液中的阳离子至少有两种 |
| C.若m=0.19g,则该合金中的另一种金属可能是铜 |
| D.如果该合金为铁和锌,则所加稀盐酸溶质质量分数一定大于7.3% |