全一卷
1.“绿水青山就是金山银山”,下列做法符合“建设美丽家乡”理念的是
| A.大力提倡作物秸秆就地燃烧为土壤提供草木灰 | B.垃圾分类处理,回收可再生资源 |
| C.大量施用化肥和农药,提高农作物产量 | D.废旧电池应深埋处理 |
2.下列选项中关于性质或变化的说法正确的是
| A. | 铁在潮湿环境中易生锈 | 化学性质 |
| B. | 酒精挥发 | 化学变化 |
| C. | 氧气用于急救病人 | 物理性质 |
| D. | 木材燃烧 | 物理变化 |
| A.A | B.B | C.C | D.D |
3.下列实验操作正确的是
A. 移走蒸发皿 移走蒸发皿 | B. 过滤 过滤 |
C. 稀释浓硫酸 稀释浓硫酸 | D. 滴加液体 滴加液体 |
4.乙烯产量是衡量一个国家或地区石油化工发展水平的标志。乙烯具有广泛用途,如可以合成装食品用的聚乙烯塑料袋,也可以发生如下图所示的反应合成乙醇。
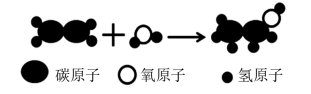
则下列说法正确的是

则下列说法正确的是
| A.酒精灯失火时用湿毛巾盖灭是利用了降低着火点的原理 |
| B.聚乙烯塑料属于有机高分子材料 |
| C.上图所示说明了分子在化学变化中不可分 |
| D.据图所示可知,乙醇分子中碳元素、氢元素、氧元素质量比为2:6:1 |
5.青少年的健康问题日益引起人们重视。某同学某天中午的食谱:米饭、回锅肉、炸鸡块、牛奶,从营养均衡的角度分析,还需要补充的食物是
| A.蒸蛋 | B.清蒸鱼 | C.炒青菜 | D.包子 |
6.北斗系统的全面建成彰显了中国航天的力量。在航天科技中运用了大量金属材料,下列有关金属材料的说法正确的是
| A.纯金属的硬度一般比它们组成合金的硬度更高 |
| B.钛和钛合金被广泛应用于火箭、导弹等 |
| C.金属单质在常温下都是固体 |
| D.合金中一定只含金属元素 |
7.分类是学习化学的一种重要方法。现有一氧化碳、五氧化二磷、水、三氧化二铁四种物质,可将一氧化碳、五氧化二磷、水归为一类,剩下的是三氧化二铁。这样分类的依据是
| A.常温下是否为固体 | B.是否为非金属氧化物 |
| C.是否为氧化物 | D.是否为纯净物 |
8.2021年3月20日,三星堆遗址考古工作中发现了生锈的铜器,已知铜锈的主要成分为碱式碳酸铜【Cu2(OH)aCO3】。经查阅资料可知铜元素在元素周期表中有如图所示的信息,下列说法正确的是


| A.乙图中x的值可能为2 | B.铜的相对原子质量为63.55g |
| C.碱式碳酸铜【Cu2(OH)aCO3】中a为2 | D.铜是活泼金属,能与稀硫酸发生置换反应 |
9.没有空气就没有生命,水是一切生命体生存所必需的物质,下列关于空气和水的说法正确的是
| A.空气中氧气的质量分数约为21% | B.用肥皂水可以鉴别硬水与软水 |
| C.为了节约用水,提倡直接用工业废水灌溉农田 | D.电解水实验中,正极产生氢气 |
10.除去下列各物质中的少量杂质,所选用的试剂和方法均正确的是
| 编号 | 物质 | 杂质 | 试剂 | 除杂操作方法 |
| A | CuO | C(木炭) | 足量稀盐酸 | 过滤、洗涤、干燥 |
| B | CaCl2溶液 | HCl | 过量CaCO3粉末 | 过滤 |
| C | CO2 | CO | O2 | 点燃 |
| D | NaNO3溶液 | NaCl | 过量AgNO3溶液 | 过滤 |
| A.A | B.B | C.C | D.D |
11.如图所示的四个图像表示的变化趋势,分别对应四种操作过程,其中正确的是
A. 氢氧化钠溶液中加入足量的水稀释 氢氧化钠溶液中加入足量的水稀释 |
B. 加热一定量氯酸钾和二氧化锰的混合物 加热一定量氯酸钾和二氧化锰的混合物 |
C. 等质量的镁和铁与足量的稀硫酸反应 等质量的镁和铁与足量的稀硫酸反应 |
D. 将一定质量的硫酸铜溶液倒入盛有铁钉的烧杯中 将一定质量的硫酸铜溶液倒入盛有铁钉的烧杯中 |
12.如图是四种物质的溶解度曲线,下列说法正确的是
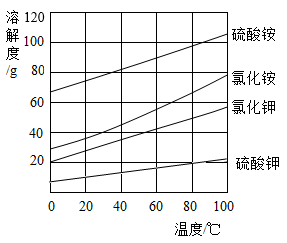

| A.20℃时,分别配制四种物质的饱和溶液,硫酸铵需要水的质量最少 |
| B.40℃时,向硫酸铵饱和溶液中加入适量氯化钾固体,会析出硫酸钾晶体 |
| C.氯化钾饱和溶液的溶质质量分数一定小于氯化铵饱和溶液的溶质质量分数 |
| D.用30g硫酸钾固体最多可配制150g80℃的硫酸钾饱和溶液 |
13.某无色混合溶液中大量存在四种离子,其个数比为A13+: :
: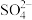 :M=1:1:3:2,则M为
:M=1:1:3:2,则M为
 :
: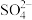 :M=1:1:3:2,则M为
:M=1:1:3:2,则M为| A.Cu2+ | B.Na+ | C.C1- | D.Mg2+ |
14.某溶液可能含有盐酸、硫酸、硝酸钾、氯化铜中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。下列相关说法正确的是
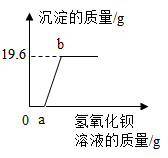

| A.反应过程生成的沉淀一定有氢氧化铜,可能有硫酸钡 |
| B.加入氢氧化钡溶液至过量,共发生了三个化学反应 |
| C.该溶液一定含有盐酸、氯化铜,可能含有硝酸钾 |
| D.到达b点时所消耗氢氧化钡溶液中溶质的质量是34.2g |
15.化学和我们生产与生活息息相关,我们应该学好化学,将来为社会更好地服务。根据信息回答下列问题:
(1)用元素符号或化学式填空:3个过氧化氢分子_______ ;人体内缺乏_______ 元素会引起贫血。
(2)选择下列适当物质填空(填序号字母)
A 硝酸钾 B 氯化钠 C 干冰 D 明矾 E 一氧化碳
可用于净化水的物质是____ ,属于复合肥料的物质是____ ,可用于人工降雨的物质是____ 。
(3)将少量下列物质分别放入足量的水中,充分搅拌,可以得到无色溶液的是(填序号字母)_____
A 氯化铁 B 葡萄糖 C 菜籽油 D 面粉
(1)用元素符号或化学式填空:3个过氧化氢分子
(2)选择下列适当物质填空(填序号字母)
A 硝酸钾 B 氯化钠 C 干冰 D 明矾 E 一氧化碳
可用于净化水的物质是
(3)将少量下列物质分别放入足量的水中,充分搅拌,可以得到无色溶液的是(填序号字母)
A 氯化铁 B 葡萄糖 C 菜籽油 D 面粉
16.酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的硝酸钡、碳酸钠、氢氧化钾、稀硫酸、氢氧化钙五瓶无色溶液,现将其任意编号A、B、C、D、E,然后两两混合进行实验,其部分现象如下表(微溶物视为可溶物)。
①碳酸钠俗称纯碱,属于_______ 类(填序号字母)
A 酸 B 碱 C 盐
②写出溶液B中溶质的化学式______ 。
③写出溶液A与E反应的化学方程式_______ 。
(2)我国制碱工业先驱候德榜发明了“候氏制碱法”,其主要化学原理: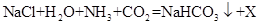 ;
; 等。则X的化学式为
等。则X的化学式为____ 。
(1)化学实验室有失去标签的硝酸钡、碳酸钠、氢氧化钾、稀硫酸、氢氧化钙五瓶无色溶液,现将其任意编号A、B、C、D、E,然后两两混合进行实验,其部分现象如下表(微溶物视为可溶物)。
| 实验 | A+E | A+B | B+C | B+E |
| 现象 | 产生沉淀 | 产生沉淀 | 产生沉淀 | 产生气体 |
A 酸 B 碱 C 盐
②写出溶液B中溶质的化学式
③写出溶液A与E反应的化学方程式
(2)我国制碱工业先驱候德榜发明了“候氏制碱法”,其主要化学原理:
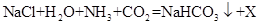 ;
; 等。则X的化学式为
等。则X的化学式为17.“珍爱生命,远离毒品”,冰毒是一种危害性很大的毒品,其主要成分是甲基苯丙胺(化学式为C10H15N)。某化学学习小组模拟对毒品的销毁,利用所制得的氧气燃烧冰毒,并检验所生成的二氧化碳气体,设计了如下实验。
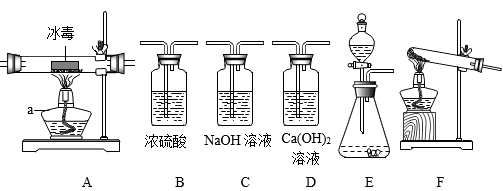
本次实验只提供了如下化学试剂:5%的过氧化氢溶液,二氧化锰固体,浓硫酸,NaOH溶液,Ca(OH)2溶液,冰毒。请回答下列问题:
(1)仪器a的名称是_______ 。
(2)为了完成此实验,除了选择装置B以外,还应选择的装置组合是______ (填装置序号字母)
(3)连接好装置,在加入药品前还必须进行的操作是_______ 。
(4)检验二氧化碳时所发生反应的化学方程式为_______ 。

本次实验只提供了如下化学试剂:5%的过氧化氢溶液,二氧化锰固体,浓硫酸,NaOH溶液,Ca(OH)2溶液,冰毒。请回答下列问题:
(1)仪器a的名称是
(2)为了完成此实验,除了选择装置B以外,还应选择的装置组合是
(3)连接好装置,在加入药品前还必须进行的操作是
(4)检验二氧化碳时所发生反应的化学方程式为
18.2009年,我国华为公司推出了5G商用芯片,制造芯片要用到高纯硅,以下为制备高纯硅和二氧化硅的主要工艺流程。
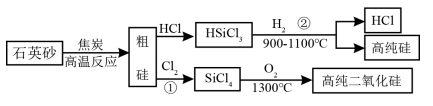
(1)反应①从基本反应类型角度分析,该反应属于_______ 反应。
(2)反应②的化学方程式为_______ ,该反应中,在工艺流程中可以循环利用的物质_______ 。

(1)反应①从基本反应类型角度分析,该反应属于
(2)反应②的化学方程式为
19.有一包从海水中获得的粗盐,已经经过初步提纯。课外活动小组对它的成分进行探究,并将粗盐进一步提纯。一些物质的溶解性
探究过程:
Ⅰ.探究一:这包粗盐中可能有的杂质是CaCl2和MgCl2。
现用实验验证这种假设:取样品并溶解,加入数滴NaOH溶液,无明显现象,说明粗盐中无____ ;另取样品并溶解,加入数滴碳酸钠溶液,有白色沉淀生成。
实验证明:这包粗盐中含有的杂质是_______ 。
Ⅱ.探究二:这包粗盐中NaCl的质量分数。按下面步骤进行实验:
①称取ag的样品;
②将样品加水溶解,制成粗盐溶液;
③向粗盐溶液中加入过量的某种试剂,过滤,得到沉淀和滤液;
④将③中所得沉淀洗涤后小心烘干,称量得到bg纯净固体M;
⑤向③中所得滤液逐滴滴入稀盐酸,直到不再产生气泡为止后,移入蒸发皿蒸发,称量得到cg纯净固体N;
(1)②③⑤的步骤中,都使用到同一仪器是_____ ;它在步骤②和⑤中的操作方法相同,但目的不同,在步骤②中的目的是_______ 。
(2)步骤③中加入的试剂是______ ;目的是_______ 。
(3)根据以上实验可知粗盐中NaCl的质量分数为(用含字母的代数式表达)_______ 。
| | OH- | Cl- |  | 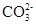 |
| H+ | | 溶、挥 | 溶 | 溶、挥 |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 微 |
Ⅰ.探究一:这包粗盐中可能有的杂质是CaCl2和MgCl2。
现用实验验证这种假设:取样品并溶解,加入数滴NaOH溶液,无明显现象,说明粗盐中无
实验证明:这包粗盐中含有的杂质是
Ⅱ.探究二:这包粗盐中NaCl的质量分数。按下面步骤进行实验:
①称取ag的样品;
②将样品加水溶解,制成粗盐溶液;
③向粗盐溶液中加入过量的某种试剂,过滤,得到沉淀和滤液;
④将③中所得沉淀洗涤后小心烘干,称量得到bg纯净固体M;
⑤向③中所得滤液逐滴滴入稀盐酸,直到不再产生气泡为止后,移入蒸发皿蒸发,称量得到cg纯净固体N;
(1)②③⑤的步骤中,都使用到同一仪器是
(2)步骤③中加入的试剂是
(3)根据以上实验可知粗盐中NaCl的质量分数为(用含字母的代数式表达)
20.常温下,一锥形瓶中盛有10g溶质质量分数为4%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加一定溶质质量分数的稀盐酸,用pH传感器测得溶液pH与加入稀盐酸的关系曲线如图所示,请回答下列问题:

(1)图中B点溶液呈_______色
(2)计算稀盐酸中溶质质量分数(写出计算过程)

(1)图中B点溶液呈_______色
(2)计算稀盐酸中溶质质量分数(写出计算过程)
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
