某学习小组对实验室制取二氧化碳及二氧化碳的性质进行如下两个方面的探究。
(一)二氧化碳的制取

第一小组用如图一所示装置制取二氯化碳并测定生成二氧化碳的体积,实验开始时他们通过分液漏斗将20mL稀盐酸快速全部加入锥形瓶中并关闭活塞,记录量筒中水的体积,数据如下表:
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
| 量筒读数/mL | 40 | 50 | 55 | 58 | 60 | 60 |
①乙中如果不加植物油会使测定结果
______(填“偏大”或“偏小”);
②在图二中绘出0—6min内生成二氧化碳体积随时间变化的曲线
_________;
③反应过程中产生二氧化碳的速率不断减慢的主要原因是
___________。
(二)二氧化碳的性质
第二小组将第一小组制取的二氧化碳通入氢氧化钠溶液中发现无任何现象,他们对二氧化碳是否与氢氧化钠反应展开探究。
探究一 证明CO
2与NaOH发生了反应
方法一:证明CO
2减少,取两瓶充满CO
2的矿泉水瓶,一瓶加100mL水,立即拧紧瓶塞,振荡,发现矿泉水瓶子变瘪,另一瓶加入100mLNaOH溶液,操作同上,得到溶液X,此时观察到的现象是
_________,证明CO
2与NaOH发生了反应。
方法二:证明有新物质生成。取上述所得溶液X少许,向其中滴加BaCl
2溶液,有白色沉淀产生,该反应的化学方程式为
___________,证明CO
2与NaOH发生了反应。
方法三:用数字实验测定反应过程中溶液的pH和温度的变化。将CO
2持续通入一定浓度的NaOH溶液中,测试结果分别如图所示。

【查阅资料】
Ⅰ. NaOH和Ca(OH)
2性质相似。
Ⅱ.①CO
2通入澄清石灰水中,澄清石灰水变浑浊,继续通入CO
2浑浊的液体又变澄清了,原因是难溶于水的CaCO
3遇到CO
2和水时会生成溶解性较大的Ca(HCO
3)
2,化学反应方程式为CaCO
3+CO
2+H
2O=Ca(HCO
3)
2。
②碳酸钠和碳酸氢钠的水溶液均呈碱性,但碳酸氢钠溶液碱性更弱。
【结论】
(1)上图中BC段反应后的溶液中一定含有
____________。
(2)由上图可知该反应为
__________(填“放热”或“吸热”)。
(3)NaOH固体能与空气中的CO
2发生反应,必须密封保存。
探究二 氢氧化钠变质的程度
【提出问题】氢氧化钠露置在空气中一段时间后,其成分是什么?
【猜想假设】Ⅰ. NaOH和Na
2CO
3 Ⅱ. Na
2CO
3 Ⅲ. Na
2CO
3和
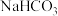
Ⅳ.
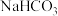
【设计与实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取样,加水溶解,滴加过量的BaCl2溶液 | 产生白色沉淀 | 猜想Ⅳ不成立 |
| ②取①静置后的上层清液,滴加稀盐酸 | 有气泡冒出 | 猜想_____成立 |
【提升拓展】将实验步骤①剩余混合物进行过滤、洗涤、干燥、称量,发现所得沉淀质量等于所称量的溶液的质量的1%,判断变质后的氢氧化钠溶液中Na
2CO
3的质量分数
_______(填写字母序号)。
A.0.54%
B.1%
C.4.26%
D.5.38%





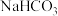 Ⅳ.
Ⅳ. 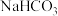



 写出Fe(OH)2转化为Fe(OH)3的化学方程式
写出Fe(OH)2转化为Fe(OH)3的化学方程式





