全一卷
1.“航天点亮梦想”。搭载神舟飞船的火箭常用液氢作燃料,液氢的化学式是
| A.H2 | B.CH4 | C.CO | D.NH3 |
2.扬州中国大运河博物馆生动还原了大运河的历史场景。下列过程涉及化学变化的是
| A.开凿河道 | B.裁制船帆 | C.炼铁铸锚 | D.伐木造桨 |
3.节约用水是保护水资源的有效途径。适合张贴在学校水龙头旁的标识是
A. | B. | C. | D. |
4.自热食品的发热包中含有CaO,它属于
| A.酸 | B.碱 | C.盐 | D.氧化物 |
5.下列物质由离子构成的是
| A.氮气 | B.硝酸钠 | C.二氧化碳 | D.金刚石 |
6.室温时,下列液体的pH小于7的是
| A.白醋 | B.蒸馏水 | C.食盐水 | D.肥皂水 |
7.防治空气污染,保护生态环境。下列做法不 合理的是
| A.开发和使用清洁能源 | B.车辆尾气净化后排放 |
| C.工业废气排放到高空 | D.管理和控制工地扬尘 |
8.从微观角度可以认识化学变化的实质。下图所示化学反应的类型为
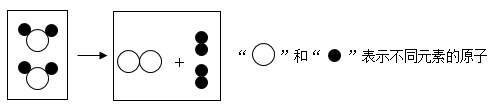

| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
9.石灰石的主要成分是CaCO3.下列说法不正确的是
| A.CaCO3属于碳酸盐 | B.贝壳和珍珠中含有CaCO3 |
| C.CaCO3易溶于水 | D.CaCO3可用作补钙剂 |
10.下列物质的性质与用途具有对应关系的是
| A.石墨能导电,可用于制作铅笔芯 | B.氮气是无色气体,可用作保护气 |
| C.一氧化碳难溶于水,可用于高炉炼铁 | D.浓硫酸具有吸水性,可用于干燥氧气 |
11.北京冬奥会火种灯使用化合物X作燃料,其燃烧反应方程式为

 。推断X的化学式是
。推断X的化学式是


 。推断X的化学式是
。推断X的化学式是| A.C3H8 | B.C3H6 | C.C2H6O2 | D.C3H8O3 |
12.制取、收集CO2并验证相关性质,下列做法不正确的是
A. 检查装置气密性 检查装置气密性 | B. 加入石灰石 加入石灰石 |
C. 收集CO2 收集CO2 | D. 验证CO2不支持燃烧 验证CO2不支持燃烧 |
13.乳酸可用作饮料中的酸味剂,分子式为C3H6O3.下列说法正确的是
| A.分子中含12种元素 | B.碳、氢元素质量比为1:2 |
| C.每个乳酸分子中含有3个水分子 | D.相对分子质量为(12×3+1×6+16×3) |
14.下列实验方案不能达到目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 除去CO2中的HCl气体 | 通过盛有NaOH溶液的洗气瓶 |
| B | 鉴别氮气和氧气 | 将带火星的木条分别伸入集气瓶 |
| C | 鉴别NaOH和NH4NO3固体 | 分别溶于水,测溶解前后液体温度变化 |
| D | 从KCl与MnO2的混合物中回收MnO2 | 加水溶解、过滤、洗涤、干燥 |
| A.A | B.B | C.C | D.D |
15.将一定量的N2、H2和物质M置于密闭容器中,在特定条件下发生化学反应,反应前后各物质的质量分数如图所示。下列说法不正确的是


| A.反应前后原子的数目不变 | B.参加反应的N2和H2分子个数比为1:3 |
| C.M可能是该反应的催化剂 | D.反应后H2和NH3质量分数之比为1:1 |
16.合金的应用和发展印证了人类文明的进步。下列有关合金的说法不 正确的是
| A.人类生产和使用铁器早于青铜器 | B.生铁和钢是铁、碳等元素形成的合金 |
| C.不锈钢属于金属材料 | D.合金拓宽了金属材料的应用范围 |
17.KNO3与KCl的溶解度曲线如图所示。下列说法正确的是


| A.10℃时,KNO3的溶解度比KCl大 |
| B.KCl的溶解度受温度影响的程度比KNO3大 |
| C.60℃时,P点表示的KNO3溶液还能继续溶解KNO3固体 |
| D.将60℃的KCl饱和溶液降温至10℃,溶液中溶质质量分数不变 |
18.下列实验现象的解释合理的是
| 选项 | 实验现象 | 解释 |
| A | 2mL无水酒精和2mL水混合后体积略小于4mL | 酒精和水发生了化学反应 |
| B | 加热滴有石蕊的碳酸溶液,溶液由红色变为紫色 | 碳酸受热分解 |
| C | 蜡烛在空气中不完全燃烧,有黑色的炭生成 | 蜡烛中含有元素C、H、O |
| D | 向鸡蛋清中加入饱和(NH4)2SO4溶液,有沉淀析出 | 蛋白质在水中溶解的量减少了 |
| A.A | B.B | C.C | D.D |
19.1783年,拉瓦锡研究水的组成,装置示意图如下,将水加热成蒸气通过灼热的铁管,一段时间后,在出口处收集到一种可燃性气体。实验后称量发现水的质量减少,铁管质量增加,拉瓦锡研究并判断铁转化为氧化物。下列说法正确的是


| A.实验中收集到的可燃性气体可能是氢气 |
| B.铁在该实验中起催化剂作用 |
| C.实验中水蒸气减少的质量等于铁管增加的质量 |
| D.该实验推翻了“水是单一元素物质”的观点 |
20.甲烷是天然气的主要成分。利用太阳能可将甲烷在高温熔融盐环境中转化为H2,反应原理如图所示,下列说法正确的是


| A.整个过程中,只有Zn的化合价发生变化 |
B.过程①的化学反应为   |
| C.理论上过程①与过程②中产生H2的质量比为2:1 |
| D.当参加反应的CH4与H2O质量比为8:9时,理论上可不补充ZnO |
21.化学提升生活品质,助力未成年人健康成长。
(1)扬州某中学的午餐食谱如图:
①合理膳食可增强体质。下列说法不 正确的是_______ 。
A.鱼片含有丰富蛋白质
B.淀粉可分解为氨基酸
C.适度补充油脂,有益身体健康
②若需补充维生素C,建议多吃食谱中_______ (写出一种即可)。
③食用加碘盐可补充碘元素。下列说法正确的是_______ 。
A.人体中缺少碘元素,会导致骨质疏松
B.除加碘盐外,还可以通过食用海带等海产品补充碘元素
C.加碘盐中添加了碘酸钾(KIO3),淀粉可用于检验其中碘元素的存在
④学校正推行垃圾分类。餐后的食物残渣应投入印有_______ 标识的垃圾箱。
(2)校服面料常用棉花、羊毛等混纺制成。棉花_______ 溶于水中(填“难”或“易”):生活中常用_______ 法区分羊毛线和棉线。
(3)骑自行车属于低碳生活新时尚。

①下列做法不属于低碳生活方式的是_______ 。
A.随手关灯
B.旧书本循环利用
C.夏天将空调温度调至最低
②下列做法不利于自行车防锈的是_______ 。
A.金属部件镀金属铬
B.链条涂防锈油
C.雨淋后自然晾干
③铁锈成分中含有氧化铁(Fe2O3),写出氧化铁与稀硫酸反应的化学方程式_______ 。
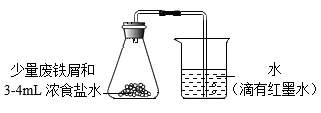
④某学生做了铁的锈蚀实验,装置如图。一段时间后可观察到导管内红墨水的液面_______ (填“上升”或“下降”)。
(1)扬州某中学的午餐食谱如图:
| 红烧狮子头 水煮鱼片 炒青菜、海带汤 米饭、桔子 |
①合理膳食可增强体质。下列说法
A.鱼片含有丰富蛋白质
B.淀粉可分解为氨基酸
C.适度补充油脂,有益身体健康
②若需补充维生素C,建议多吃食谱中
③食用加碘盐可补充碘元素。下列说法正确的是
A.人体中缺少碘元素,会导致骨质疏松
B.除加碘盐外,还可以通过食用海带等海产品补充碘元素
C.加碘盐中添加了碘酸钾(KIO3),淀粉可用于检验其中碘元素的存在
④学校正推行垃圾分类。餐后的食物残渣应投入印有

(2)校服面料常用棉花、羊毛等混纺制成。棉花
(3)骑自行车属于低碳生活新时尚。

①下列做法不属于低碳生活方式的是
A.随手关灯
B.旧书本循环利用
C.夏天将空调温度调至最低
②下列做法不利于自行车防锈的是
A.金属部件镀金属铬
B.链条涂防锈油
C.雨淋后自然晾干
③铁锈成分中含有氧化铁(Fe2O3),写出氧化铁与稀硫酸反应的化学方程式
④某学生做了铁的锈蚀实验,装置如图。一段时间后可观察到导管内红墨水的液面

22.粮食安全是“国之大者”
(1)守住良田沃土,保障粮食安全。
①土壤酸化不利于农作物生长。要改良酸化土壤,可选用的物质为_______ 。
A.KNO3 B.熟石灰 C.稀硫酸
②某农田改良后pH为5.4,该地区常见农作物最适宜生长的土壤pH范围如下:
该农田适合种植的农作物是_______ 。
③化肥和农药对农业增产有重要作用。下列说法不 正确的是_______ 。
A.铵态氮肥不能与草木灰混用
B.磷酸二氢铵(NH4H2PO4)属于复合肥料
C.为增加农作物产量,大量使用化肥和农药
④碳酸氢铵(NH4HCO3)需密封保存于阴凉处,用化学方程式解释原因_______ 。
(2)科技创新,开辟产粮新路径。
我国科学家利用CO2合成葡萄糖,该方案先用碳电还原法将CO2转化为醋酸,再利用微生物发酵获得葡萄糖。
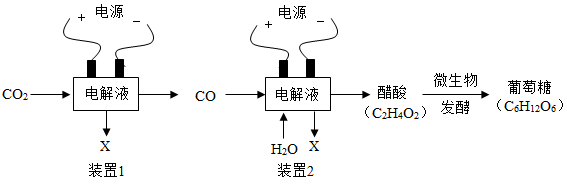
①将CO2资源化利用,可减少_______ 效应。
②通电条件下,装置1中CO2分解成CO和常见单质X,X的化学式为_______ 。
③利用酵母菌等微生物将醋酸转化为葡萄糖时,温度不宜过高,原因是_______ 。
④理论上合成葡萄糖所需CO2与H2O的质量比为_______ 。
(1)守住良田沃土,保障粮食安全。
①土壤酸化不利于农作物生长。要改良酸化土壤,可选用的物质为
A.KNO3 B.熟石灰 C.稀硫酸
②某农田改良后pH为5.4,该地区常见农作物最适宜生长的土壤pH范围如下:
| 农作物 | 茶树 | 油菜 | 水稻 | 萝卜 |
| pH | 5.0-5.5 | 5.8-6.7 | 6.0-7.0 | 7.0-7.5 |
该农田适合种植的农作物是
③化肥和农药对农业增产有重要作用。下列说法
A.铵态氮肥不能与草木灰混用
B.磷酸二氢铵(NH4H2PO4)属于复合肥料
C.为增加农作物产量,大量使用化肥和农药
④碳酸氢铵(NH4HCO3)需密封保存于阴凉处,用化学方程式解释原因
(2)科技创新,开辟产粮新路径。
我国科学家利用CO2合成葡萄糖,该方案先用碳电还原法将CO2转化为醋酸,再利用微生物发酵获得葡萄糖。

①将CO2资源化利用,可减少
②通电条件下,装置1中CO2分解成CO和常见单质X,X的化学式为
③利用酵母菌等微生物将醋酸转化为葡萄糖时,温度不宜过高,原因是
④理论上合成葡萄糖所需CO2与H2O的质量比为
23.海水中含有大量盐类,海水淡化是综合利用海洋资源的重要产业。某种海水淡化装置允许水分子透过,阻止盐类透过。采用该装置淡化海水,可分别获得浓盐水和淡水。
(1)①进入淡化装置前的海水必须进行预处理,可用纯碱除去大部分钙盐和镁盐,写出纯碱与CaCl2生成沉淀的化学方程式_______ 。
②分离出的浓盐水是_______ (填“纯净物”或“混合物”)。
③该方法除了用于海水淡化,还可用于_______ 。
A.硬水软化 B.污水处理 C.物质鉴别
(2)某工厂淡化海水后得到的浓盐水和淡水中盐类物质含量如下表(微量盐类忽略不计)。
国家规定居民生活用水中盐类物质总含量≤500mg·L-1,计算并推断所得淡水中盐类总含量_______ 生活用水的标准(填“达到”或“未达到”);该工厂一套淡化装置每小时产生浓盐水300L,其中含有NaCl_______ kg。
(3)淡化海水所得的浓盐水中含大量MgCl2,可制备金属镁,主要物质转化关系如图所示:

①写出生成Mg(OH)2的反应方程式_______ 。
②浓盐水经过步骤1和2两步反应后又获得了MgCl2,设计这两步的目的是_______ 。
③图中未涉及的反应类型为_______ 。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
④镁在空气中燃烧发出耀眼白光,依据此现象可用镁制作_______ (写出一种即可)。
(1)①进入淡化装置前的海水必须进行预处理,可用纯碱除去大部分钙盐和镁盐,写出纯碱与CaCl2生成沉淀的化学方程式
②分离出的浓盐水是
③该方法除了用于海水淡化,还可用于
A.硬水软化 B.污水处理 C.物质鉴别
(2)某工厂淡化海水后得到的浓盐水和淡水中盐类物质含量如下表(微量盐类忽略不计)。
国家规定居民生活用水中盐类物质总含量≤500mg·L-1,计算并推断所得淡水中盐类总含量
 | 氯化钠 | 氯化镁 | 硫酸镁 | 硫酸钙 |
| 淡水 | 0.17 | 0.012 | 4.8×10-4 | 8.5×10-4 |
| 浓盐水 | 45.0 | 3.6 | 3.3 | 0.14 |

①写出生成Mg(OH)2的反应方程式
②浓盐水经过步骤1和2两步反应后又获得了MgCl2,设计这两步的目的是
③图中未涉及的反应类型为
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
④镁在空气中燃烧发出耀眼白光,依据此现象可用镁制作
24.为认识酸和碱的性质,某化学学习小组进行了如下实验。
(1)20℃时,配制80g溶质质量分数为10%的NaOH溶液。

①用图中仪器完成实验,还缺少的玻璃仪器是____ (填名称),玻璃棒在配制实验中的作用是___ 。
②配制该溶液需要_______ g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数___ 10%。(填“大于”或“小于”)
(2)向1~5号小试管中分别滴加少量稀盐酸。
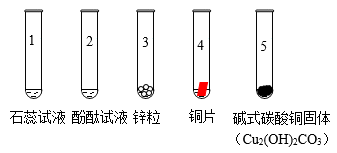
①_______ 中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生气泡,试管4中无明显现象,由此推断金属活动性Cu比Zn_______ (填“强”或“弱”)。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为_______ 。
(3)借助传感器对稀NaOH溶液与稀盐酸的中和反应进行研究,实验装置如图,三颈烧瓶中盛放溶液X,用恒压漏斗匀速滴加另一种溶液。

①甲同学用pH传感器测得三颈烧瓶内溶液pH的变化如题图,判断溶液X是_____ ,实验进行到60s时溶液中的溶质为_____ (填化学式)。
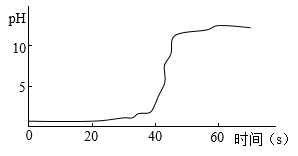
②乙同学用温度传感器测得三颈烧瓶内温度变化如图(实验过程中热量散失忽略不计),据此可得出反应过程中_____ 能量的结论(填“吸收”或“释放”)。

③丙同学提出,通过监测三颈烧瓶内压强变化,也可以推导出乙同学的实验结论,其理由是____ 。
(1)20℃时,配制80g溶质质量分数为10%的NaOH溶液。

①用图中仪器完成实验,还缺少的玻璃仪器是
②配制该溶液需要
(2)向1~5号小试管中分别滴加少量稀盐酸。

①
②试管3中产生气泡,试管4中无明显现象,由此推断金属活动性Cu比Zn
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为
(3)借助传感器对稀NaOH溶液与稀盐酸的中和反应进行研究,实验装置如图,三颈烧瓶中盛放溶液X,用恒压漏斗匀速滴加另一种溶液。

①甲同学用pH传感器测得三颈烧瓶内溶液pH的变化如题图,判断溶液X是

②乙同学用温度传感器测得三颈烧瓶内温度变化如图(实验过程中热量散失忽略不计),据此可得出反应过程中

③丙同学提出,通过监测三颈烧瓶内压强变化,也可以推导出乙同学的实验结论,其理由是
25.电石渣[主要成分为Ca(OH)2,还含有MgO等杂质]是一种工业废渣,以它为原料可生产纳米碳酸钙,制备方案如下:
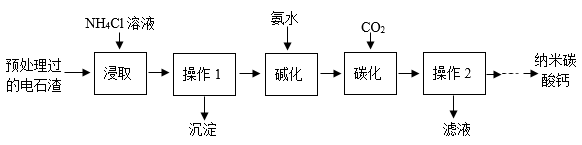
已知:①NH4Cl溶液显酸性;
②“浸取”时的主要反应为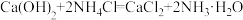 ;
;
③“碳化”时的主要反应为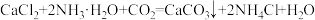 。
。
(1)电石渣久置在空气中会产生一定量的碱式碳酸钙[Ca3(OH)2(CO3)n],化学式中的n为_______ 。
(2)用不同质量分数的NH4Cl溶液浸取电石渣时,Ca元素提取率和Mg元素去除率的数值如图所示,你认为较适宜的NH4Cl质量分数是_______ 。

(3)浸取时,向浸取液中滴加氨水调节pH,将镁元素全部沉淀,则操作1为_______ (填操作名称)。
(4)工业上将操作1所得溶液碱化后,进行喷雾碳化,碳化塔的构造如图所示,CO2从_______ 处通入(填“A”或“B”),其目的是_______ 。

(5)测得不同温度下碳化反应所需时间如下表(其他条件相同):
实际碳化反应的温度采用了60℃,温度不宜过高的原因可能是_______ (写出一条即可)。
(6)该工艺流程的核心反应在“浸取”和“碳化”这两步,请书写由Ca(OH)2制备碳酸钙的总反应方程式_______ 。结合制备方案判断可循环利用的物质为_______ 。
(7)用电石渣[Ca(OH)2质量分数92.5%]制备1tCaCO3,计算所需电石渣的质量(写出计算过程)。_______ 。

已知:①NH4Cl溶液显酸性;
②“浸取”时的主要反应为
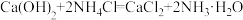 ;
;③“碳化”时的主要反应为
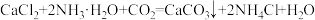 。
。(1)电石渣久置在空气中会产生一定量的碱式碳酸钙[Ca3(OH)2(CO3)n],化学式中的n为
(2)用不同质量分数的NH4Cl溶液浸取电石渣时,Ca元素提取率和Mg元素去除率的数值如图所示,你认为较适宜的NH4Cl质量分数是

(3)浸取时,向浸取液中滴加氨水调节pH,将镁元素全部沉淀,则操作1为
(4)工业上将操作1所得溶液碱化后,进行喷雾碳化,碳化塔的构造如图所示,CO2从

(5)测得不同温度下碳化反应所需时间如下表(其他条件相同):
| 温度 | 反应液浑浊所需时间(单位:秒) | 反应完全所需时间(单位:分钟) |
| 20℃ | 480 | >180 |
| 40℃ | 120 | 180 |
| 60℃ | 1 | 50 |
| 80℃ | 1 | 68 |
实际碳化反应的温度采用了60℃,温度不宜过高的原因可能是
(6)该工艺流程的核心反应在“浸取”和“碳化”这两步,请书写由Ca(OH)2制备碳酸钙的总反应方程式
(7)用电石渣[Ca(OH)2质量分数92.5%]制备1tCaCO3,计算所需电石渣的质量(写出计算过程)。
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
