| A.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
| B.参加反应的金属的总质量3.6g<m<9.6g |
| C.当生成的沉淀量达到最大时,消耗NaOH溶液的体积一定为V=100mL |
| D.当金属全部溶解时收集到NO气体的体积在标准状况下为2.24L |
 [Cu(NH3)3]2+
[Cu(NH3)3]2+ [Cu(NH3)2]2+
[Cu(NH3)2]2+ [Cu(NH3)]2+
[Cu(NH3)]2+ Cu2+。向某浓度的硫酸铜溶液中滴加浓氨水,实验测得含Cu微粒的物质的量分布分数(δ)与溶液中游离氨的lgc(NH3)关系如图所示。下列说法正确的是
Cu2+。向某浓度的硫酸铜溶液中滴加浓氨水,实验测得含Cu微粒的物质的量分布分数(δ)与溶液中游离氨的lgc(NH3)关系如图所示。下列说法正确的是
A. < < |
| B.曲线c表示[Cu(NH3)2]2+ |
| C.lgc(NH3)=-4时,c(Cu2+)>c([Cu(NH3)]2+)>c([Cu(NH3)2]2+) |
D.M点时,lgc(NH3)= |
 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2 C(s)+2H2(g) △H3
C(s)+2H2(g) △H3 CO2(g)+C(s) △H4
CO2(g)+C(s) △H4 H2O(g)+C(s) △H5
H2O(g)+C(s) △H5| A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| B.移去部分C(s),反应c、d、e的平衡均向右移动 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |
 CO2(aq)
CO2(aq) H+(aq)+
H+(aq)+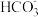 (aq)
(aq)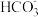 的电离)。
的电离)。 M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa.保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于
M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa.保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于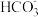 ):c(
):c( )=2:1,溶液pH=
)=2:1,溶液pH=



| A.化合物E可以发生消去反应、还原反应 |
| B.化合物F和G可通过FeCl3溶液鉴别 |
| C.化合物C中至少有7个碳共平面 |
| D.化合物H的分子式是C19H18O2NP |
 为原料,设计化合物
为原料,设计化合物 的合成路线(用流程图表示,无机试剂、有机溶剂任选)
的合成路线(用流程图表示,无机试剂、有机溶剂任选)





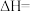
 ,相同时间内测量逸出气体中
,相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(即NO的转化率),结果下图所示。
的含量,从而确定尾气脱氮率(即NO的转化率),结果下图所示。

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 ,实验测得:
,实验测得: ,
, ,
, 、
、 分别是正、逆反应速率常数,且只是温度的函数。下列说法中正确的是
分别是正、逆反应速率常数,且只是温度的函数。下列说法中正确的是 随1/T增大而增大
随1/T增大而增大 时达到平衡,测得反应过程中CO的转化率与时间的关系如下图,则a点处对应的
时达到平衡,测得反应过程中CO的转化率与时间的关系如下图,则a点处对应的


 溶液共热后,经酸化后有两种有机产物甲和乙。甲分子含4种化学环境不同的氢,既能遇
溶液共热后,经酸化后有两种有机产物甲和乙。甲分子含4种化学环境不同的氢,既能遇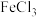 溶液显紫色也能与
溶液显紫色也能与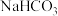 溶液反应,乙分子含3种化学环境不同的氢,遇
溶液反应,乙分子含3种化学环境不同的氢,遇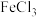 溶液
溶液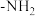 易被氧化,写出以
易被氧化,写出以 和
和 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图例见本题题干) 、
、 )进行综合处理的一种工艺流程如下:
)进行综合处理的一种工艺流程如下:
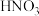 应选用
应选用 还原过程中产生了对环境友好的气体,写出该反应的离子方程式:
还原过程中产生了对环境友好的气体,写出该反应的离子方程式: ,其阳极的电极反应式为
,其阳极的电极反应式为
 )
)
A.“狗烯” 的一氯代物共有15 种 的一氯代物共有15 种 |
B.组成和结构可用 表示的有机物共有16种 表示的有机物共有16种 |
| C.含有两个碳碳三键的脂肪烃C6H6,分子中6个碳原子不都在同一直线上的共有4种 |
D.分子结构中含 、 、 、-CH2-、Cl-各1个及3个-CH3的有机物共有8种 、-CH2-、Cl-各1个及3个-CH3的有机物共有8种 |
 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。 理论推测
理论推测 的空间构型为
的空间构型为 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )
)
 ),它可用于阻燃剂、水泥减水剂和高分子合成等领域。请回答:
),它可用于阻燃剂、水泥减水剂和高分子合成等领域。请回答:
 体积的实验方案
体积的实验方案 )。
)。 在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成链状二聚物,其方程式为:
在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成链状二聚物,其方程式为:

 发生缩合反应失去
发生缩合反应失去
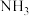 ,生成二聚物和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算各缩合产物的物质的量之比
,生成二聚物和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算各缩合产物的物质的量之比