 )。向 20 mL 0.1
)。向 20 mL 0.1  的氨水中滴加未知浓度的稀硫酸,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法不正确的是
的氨水中滴加未知浓度的稀硫酸,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法不正确的是
A.稀硫酸中溶质的物质的量浓度为0.05 |
| B.当溶液中pH = pOH时,水的电离程度最大 |
C.b点时溶液中存在 |
D.a、b、c三点对应 的水解平衡常数: 的水解平衡常数: |

A.CH3COOA溶液中 |
B.a点溶液中: |
C.稀释b点溶液时 减小 减小 |
D.pH=7时溶液中: |






 的
的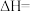
 得到的
得到的 和
和 进一步合成甲醇,反应方程式为
进一步合成甲醇,反应方程式为
 。
。 的转化率
的转化率 的转化率。
的转化率。 和3 mol
和3 mol 进行上述合成甲醇的反应。测得
进行上述合成甲醇的反应。测得 和
和 的浓度随时间的变化如图所示:
的浓度随时间的变化如图所示:
 (保留三位有效数字)。
(保留三位有效数字)。 ℃时,在2L密闭容器中发生反应
℃时,在2L密闭容器中发生反应
 ,反应过程中部分数据如下表所示:
,反应过程中部分数据如下表所示:| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II绝热恒容 | 0min | 0 | 0 | 2 | 2 |

 和1 mol
和1 mol ,则平衡
,则平衡 、CN-、苯酚等物质
、CN-、苯酚等物质 。
。 氧化成PO
氧化成PO ,该反应的离子方程式为
,该反应的离子方程式为 模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示。
模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示。



 捕集及利用具有重要意义。在传统钉配合物催化作用下
捕集及利用具有重要意义。在传统钉配合物催化作用下 加氢合成甲酸发生反应I,同时还伴有反应II发生。
加氢合成甲酸发生反应I,同时还伴有反应II发生。




| 化学键 | H-H | C-O | H-O | C-H |  |  |
E/( ) ) | 436 | 343 | 465 | 413 | 745 | a |
 (g)、
(g)、 (g)、
(g)、 (g)和CO(g)相对能量分别为-393
(g)和CO(g)相对能量分别为-393 、0
、0 、-242
、-242 和-110
和-110 ,则
,则
 和2mol
和2mol ,在不同温度下发生上述反应。反应10min时测得各容器内
,在不同温度下发生上述反应。反应10min时测得各容器内 的物质的量如图所示。
的物质的量如图所示。
 、
、 、
、 ,则
,则 、
、 、
、 之间的大小关系为
之间的大小关系为 )高于容器II的原因是
)高于容器II的原因是 ,则10min内
,则10min内 的平均反应速率
的平均反应速率
 ,反应Ⅰ的标准平衡常数
,反应Ⅰ的标准平衡常数
 ,
, 其中
其中 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。 和2mol
和2mol ,若只发生反应II,达到平衡时,
,若只发生反应II,达到平衡时, 的体积分数为A,再充入1molCO和1mol
的体积分数为A,再充入1molCO和1mol (g),一段时间后再次平衡,
(g),一段时间后再次平衡, 的体积分数为B,则A
的体积分数为B,则A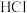 气体调节
气体调节 氨水的
氨水的 ,溶液中微粒浓度的对数值(
,溶液中微粒浓度的对数值( )、反应物的物质的量之比[
)、反应物的物质的量之比[ ]与
]与 的关系如图所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是
的关系如图所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是
A.25℃时, 的电离平衡常数为 的电离平衡常数为 |
B. 所示溶液中: 所示溶液中: |
C. 所示溶液中: 所示溶液中: |
D. 所示溶液中: 所示溶液中: |
 、
、 、
、 、
、 的负对数
的负对数 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是
A.曲线①表示 随溶液pH的变化情况 随溶液pH的变化情况 |
B.曲线①和曲线②的交点对应的溶液中存在 |
C.常温下,将A点对应溶液加水稀释, 不变 不变 |
D.等物质的量浓度、等体积的NaA溶液与HA溶液混合后: |
 的空间构型是
的空间构型是
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为| N—N | N≡N | P—P | P≡P |
| 193 | 946 | 197 | 489 |
 )形式存在的原因是
)形式存在的原因是 电子总数相同的等电子体的分子式为
电子总数相同的等电子体的分子式为
 和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO
和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
、K+在晶胞xz面、yz面上的位置:

 是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:
是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:

 与
与 溶液的反应属于非氧化还原反应。请回答:
溶液的反应属于非氧化还原反应。请回答: 的元素有
的元素有 的化学式为
的化学式为 与浓
与浓 溶液共热的化学方程式为
溶液共热的化学方程式为 中的溶质有:
中的溶质有: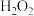 、
、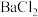 、
、 中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:
中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案: 中加
中加 固体,观察现象;
固体,观察现象; 中加浓
中加浓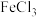 溶液,观察现象;
溶液,观察现象;