 ,还有
,还有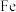 、
、 ,
, (铟)、F、
(铟)、F、 等元素】生产
等元素】生产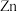 ,同时可实现稀散金属
,同时可实现稀散金属 的提取。一种工艺流程如图所示。回答下列问题:
的提取。一种工艺流程如图所示。回答下列问题:
 时,
时, ,
, ;
; 易成胶状。
易成胶状。 和
和 ,其中
,其中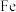 元素的化合价为
元素的化合价为 会影响锌的质量,
会影响锌的质量, 、
、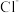 会腐蚀极板,
会腐蚀极板, 在“除杂1”中做
在“除杂1”中做 可以提高氟的沉降率,原因是
可以提高氟的沉降率,原因是 沉淀完全,“水解”时溶液的
沉淀完全,“水解”时溶液的 应不低于
应不低于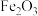 ,为后面的绿色做铺垫,冷暖对比,使其更鲜亮。基态氧原子核外电子的运动状态有
,为后面的绿色做铺垫,冷暖对比,使其更鲜亮。基态氧原子核外电子的运动状态有 。碳酸根离子的空间构型为
。碳酸根离子的空间构型为 。直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为
。直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为
 ,青金石是碱性铝硅酸盐矿物,化学式为
,青金石是碱性铝硅酸盐矿物,化学式为 。
。 与
与 结合能生成
结合能生成 ,
, 中配位原子为
中配位原子为 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是 的熔沸点比
的熔沸点比 高很多,主要原因是
高很多,主要原因是 ,有剧毒。
,有剧毒。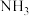 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为 代表阿伏加德罗常数的值,则砷化镓晶体的密度
代表阿伏加德罗常数的值,则砷化镓晶体的密度
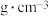 。(用含d,
。(用含d, 的代数式表示)
的代数式表示)
 由4种元素组成,某学习小组开展如图探究实验:
由4种元素组成,某学习小组开展如图探究实验:
 仅含两种元素。溶液
仅含两种元素。溶液 和溶液
和溶液 中阳离子由相同元素组成,且完全转化时,消耗标准状况下
中阳离子由相同元素组成,且完全转化时,消耗标准状况下 ,同时消耗
,同时消耗 。
。 的电子式是
的电子式是 中的金属元素是
中的金属元素是 转化为深蓝色溶液
转化为深蓝色溶液 的离子方程式
的离子方程式 加水煮沸得到绿色溶液(溶质的元素组成与沉淀
加水煮沸得到绿色溶液(溶质的元素组成与沉淀 相同),并转化为红色固体,该红色固体由一种单质和一种氧化物组成。
相同),并转化为红色固体,该红色固体由一种单质和一种氧化物组成。
 的空间构型为
的空间构型为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。 和
和 的代数式表示)。
的代数式表示)。 之间的最近距离为
之间的最近距离为 和
和 的代数式表示)。
的代数式表示)。  NH2COONH4(l)
NH2COONH4(l) [CO(NH2)2](s)+H2O(g);已知第一步反应为快速反应,△H1=-119.2kJ·mol-1,第二步反应为慢速反应,△H2=+15.5kJ·mol-1,则2NH3(g)+CO2(g)
[CO(NH2)2](s)+H2O(g);已知第一步反应为快速反应,△H1=-119.2kJ·mol-1,第二步反应为慢速反应,△H2=+15.5kJ·mol-1,则2NH3(g)+CO2(g) [CO(NH2)2](s)+H2O(g) △H3=
[CO(NH2)2](s)+H2O(g) △H3= B.
B. C.
C. D.
D.
 [CO(NH2)2](s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
[CO(NH2)2](s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则: [CO(NH2)2](s)+H2O(g),若原料气中
[CO(NH2)2](s)+H2O(g),若原料气中 =m,测得m与CO2的平衡转化率(α)的关系如图甲所示。
=m,测得m与CO2的平衡转化率(α)的关系如图甲所示。

 经催化加氢可生成甲醇,主要有以下两个反应:
经催化加氢可生成甲醇,主要有以下两个反应:



 (逆)
(逆) (正)(填“>”“<”或“=”)。
(正)(填“>”“<”或“=”)。 和
和 ,发生反应①。下列能说明该反应已达到平衡状态的是_______(填序号)。
,发生反应①。下列能说明该反应已达到平衡状态的是_______(填序号)。| A.混合气体的平均摩尔质量不再随时间变化而改变 |
B. |
C. 的物质的量不再随时间变化而改变 的物质的量不再随时间变化而改变 |
D.单位时间内每形成 键,同时形成 键,同时形成 键 键 |
 和
和 充入2L的恒容密闭容器中发生反应①和②,达到平衡状态时
充入2L的恒容密闭容器中发生反应①和②,达到平衡状态时 和
和 的物质的量分别为
的物质的量分别为 和
和 。则T温度时反应①的平衡常数K为
。则T温度时反应①的平衡常数K为 和
和 ,同时发生反应①和反应②,经相同反应时间,测得不同温度下
,同时发生反应①和反应②,经相同反应时间,测得不同温度下 转化率和
转化率和 产率的变化曲线如图1所示。
产率的变化曲线如图1所示。 时
时 产率最高的可能原因是
产率最高的可能原因是
 和
和 ,在一定条件下,发生反应:
,在一定条件下,发生反应: 。
。 的浓度随时间
的浓度随时间 变化如图2所示。其他条件不变,在
变化如图2所示。其他条件不变,在 时间将容器体积缩小至原来的一半,
时间将容器体积缩小至原来的一半, 时重新达到平衡。请画出
时重新达到平衡。请画出 时段内
时段内 浓度的变化曲线
浓度的变化曲线
 。设在容积为2.0L的密闭容器中充入
。设在容积为2.0L的密闭容器中充入 ,体系压强为
,体系压强为 ,在一定条件下达到平衡状态时,体系压强为
,在一定条件下达到平衡状态时,体系压强为 ,且
,且 ,则该条件下
,则该条件下 的平衡转化率为
的平衡转化率为 亚甲二氧基苯酚,是芝麻油重要的香气成分,也是芝麻油重要的品质稳定剂。一种制备芝麻酚H的路线如下:
亚甲二氧基苯酚,是芝麻油重要的香气成分,也是芝麻油重要的品质稳定剂。一种制备芝麻酚H的路线如下:
 中第2步反应的化学方程式
中第2步反应的化学方程式 。
。 为原料,制备
为原料,制备 的合成路线流程图
的合成路线流程图 溶液加热后得到的产物。向5
溶液加热后得到的产物。向5
 溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A(
溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A( )。
)。 溶液无色,
溶液无色, 能与
能与 反应生成
反应生成 (臭鸡蛋气味气体),能与
(臭鸡蛋气味气体),能与 反应生成
反应生成 (黑色固体)。
(黑色固体)。 溶液呈黄色,
溶液呈黄色, 能与
能与 反应生成S和
反应生成S和 ,能与
,能与 反应生成S和
反应生成S和 。
。 和
和 均不能使品红褪色,
均不能使品红褪色, 或高浓度
或高浓度 能使品红褪色。
能使品红褪色。 。
。
 的现象是
的现象是 ,甲同学认为产物还应该有
,甲同学认为产物还应该有 ,请依据氧化还原反应的规律进行解释:
,请依据氧化还原反应的规律进行解释: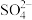 ,因为
,因为 在加热过程中可能与空气中氧气反应。
在加热过程中可能与空气中氧气反应。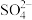 。
。 ,并认为实验III中的现象可做为证据。但乙同学认为实验III中的现象不能说明,理由是
,并认为实验III中的现象可做为证据。但乙同学认为实验III中的现象不能说明,理由是 。
。
 的实验证据是
的实验证据是 和
和 ,溶液中还会生成少量的
,溶液中还会生成少量的 、
、 和
和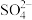 。
。  CH4(g)+ 2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示,回答下列问题:
CH4(g)+ 2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示,回答下列问题:
 的催化氧化:
的催化氧化: 。回答下列问题:
。回答下列问题: 和
和 起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,
起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下, 平衡转化率
平衡转化率 随温度的变化如图所示。反应在5.0MPa、550℃时的
随温度的变化如图所示。反应在5.0MPa、550℃时的 =
=
 催化氧化的反应速率方程为:
催化氧化的反应速率方程为: ,式中:
,式中: 为反应速率常数,随温度t升高而增大;
为反应速率常数,随温度t升高而增大; 为
为 平衡转化率,
平衡转化率, 为某时刻
为某时刻 转化率,
转化率, 为常数。在
为常数。在 时,将一系列温度下的
时,将一系列温度下的 值代入上述速率方程,得到
值代入上述速率方程,得到 曲线,如图所示。曲线上
曲线,如图所示。曲线上 最大值所对应温度称为该
最大值所对应温度称为该 下反应的最适宜温度
下反应的最适宜温度 。
。 时,
时, 逐渐提高;
逐渐提高; 后,逐渐下降。原因是
后,逐渐下降。原因是
 、Al3+、CO
、Al3+、CO 、AlO
、AlO 、S2O
、S2O 、SO
、SO 。现取该溶液进行有关实验,实验结果如图所示:
。现取该溶液进行有关实验,实验结果如图所示:
| A.淡黄色沉淀甲不可能为AgBr |
| B.气体甲可能是混合气体 |
C.综合上述信息可以确定肯定存在的离子有:Na+、AlO 、S2O 、S2O |
D.由溶液甲生成气体乙的途径只有:Al3++3HCO =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |