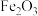 、
、 混合物共0.1 mol,加盐酸后固体全部溶解,共收集到0.01 mol
混合物共0.1 mol,加盐酸后固体全部溶解,共收集到0.01 mol  ,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为
,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为| A.0.05 mol | B.0.06 mol | C.0.07 mol | D.0.08 mol |

 ,1,
,1, ) ,则 D原子坐标为
) ,则 D原子坐标为

| A.台阶模型: Box[2][0]=KCl Box[2][1]=CO  Box[2][2]=NaOH Box[2][2]=NaOH |
| B.石砖模型: Box[1][0]=Fe2+ Box[1][1]=HNO3 Box[2][0]=SCN- Box[2][1]=Cu2+ |
| C.铁块模型: Box[0][0]=石蕊溶液 Box[0][1]=Ca2+ Box[0][2]=H2O2 Box[1][0]=SO  Box[1][1]=Ba2+ Box[1][2]=SO Box[1][1]=Ba2+ Box[1][2]=SO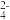 Box[2][0]=OH- Box[2][1]=CO  Box[2][2]=K+ Box[2][2]=K+ |
| D.石砖模型: Box[1][0]=OH- Box[1][1]=Al(OH)3 Box[2][0]=酚酞溶液 Box[2][1]=HCO 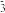 |





 之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是
之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是 的整数倍(类似任何物体的电荷数都是元电荷的整数倍):
的整数倍(类似任何物体的电荷数都是元电荷的整数倍):
 为普朗克常量,
为普朗克常量, 为电磁波频率(注:在工程学上电磁波频率用
为电磁波频率(注:在工程学上电磁波频率用 表示,二者通用)
表示,二者通用) 的光,其也存在最小能量
的光,其也存在最小能量 ,我们称之为“光子”
,我们称之为“光子” )向能量较低的轨道(能量记为
)向能量较低的轨道(能量记为 )跃迁时,会释放出能量为
)跃迁时,会释放出能量为 的光子。其能量由前后两个能级的能量差决定:
的光子。其能量由前后两个能级的能量差决定:
 ),波长记为
),波长记为 ,频率记为
,频率记为 ,满足
,满足  。
。| A.相比起氢原子跃迁之前,跃迁后氢原子自身的化学性质将会发生改变。 |
| B.氢原子由基态跃迁到激发态之后,核外电子能量增大,运动速率增大。 |
C.已知氢原子基态能量为 ,普朗克常量为 ,普朗克常量为 ,设电子的质量为 ,设电子的质量为 。则基态氢原子吸收频率为 。则基态氢原子吸收频率为 的光子被电离后,电子速度大小为 的光子被电离后,电子速度大小为 。 。 |
D.大量氢原子从基态向 能级跃迁,可能辐射出的光的频率为 能级跃迁,可能辐射出的光的频率为 代表组合数, 代表组合数, ,其中 ,其中 )。 )。 |
 )的定义式为
)的定义式为 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
 ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
 在压强与温度恒定时,若
在压强与温度恒定时,若 则正反应自发,若
则正反应自发,若  则逆反应自发,若
则逆反应自发,若  反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于
反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于| A.其反应熵变很小 |
| B.其反应需要的温度较高 |
| C.反应活化能较低 |
D.反应的体积功大( ,其中 ,其中 为其体积功) 为其体积功) |
A.在室温环境下c(OH-)=1×10-11的溶液中:Cr2+,SO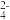 ,NO ,NO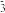 ,Na+ ,Na+ |
B.在4℃的水溶液中:Be2+,K+,PO ,OH- ,OH- |
C.在漂白液中:OH-,Rb+,SO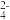 ,CO ,CO |
| D.在水玻璃中:H+,SCN-,Cl-,Cs+ |
 >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )A.当a=b时,发生的离子反应为SO +Cl2+H2O=SO +Cl2+H2O=SO +2H++2Cl- +2H++2Cl- |
B.当5a=4b时,发生的离子反应为4SO +2I-+5Cl2+4H2O=4SO +2I-+5Cl2+4H2O=4SO +I2+8H++10Cl- +I2+8H++10Cl- |
C.当a≤b≤ a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol |
D.当a<b< a时,溶液中SO a时,溶液中SO 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b |

| A.水的电离程度:c>b>a |
B.该温度下,醋酸的电离平衡常数Ka= |
| C.a点对应的混合溶液中,c(Na+)>c(CH3COOH)>c(OH-) |
| D.当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
 、CuS和惰性杂质。为进一步确定其中
、CuS和惰性杂质。为进一步确定其中 、CuS的含量,实验步骤如下:
、CuS的含量,实验步骤如下: 酸性
酸性 溶液,加热(硫元素全部转化为
溶液,加热(硫元素全部转化为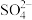 ),滤去不溶杂质后,将滤液配制成250mL溶液;
),滤去不溶杂质后,将滤液配制成250mL溶液;
 溶液滴定,消耗20.00mL;
溶液滴定,消耗20.00mL; 溶液(掩蔽
溶液(掩蔽 和
和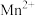 ,使其不再参与其他反应),再加入过量KI固体,轻摇使之溶解并发生反应:
,使其不再参与其他反应),再加入过量KI固体,轻摇使之溶解并发生反应: ;
; 溶液滴定,消耗30.00mL,发生反应:
溶液滴定,消耗30.00mL,发生反应: 。
。 溶于酸性
溶于酸性 溶液的离子方程式为
溶液的离子方程式为
 溶液时要用煮沸过的稀硫酸,煮沸的原因是
溶液时要用煮沸过的稀硫酸,煮沸的原因是