有这样一位意大利的自然科学家,他在1776年8月9日生于都灵的一个贵族家庭,早年致力于法学工作。
1792年入都灵大学学习法学,1796年获法学博士学位;
毕业后当律师,1796年得法学博士后曾任地方官吏;
他从1800年起开始自学数学和物理学,1803年发表了第一篇科学论文;
1804年他被都灵科学院选为通讯院士,1806年任都灵大学讲师;
……
直至1856年7月9日,他在都灵安然逝世,终年80岁。
他就是阿伏伽德罗,对科学的发展,特别是原子量的测定工作,起了重大的推动作用。
而他的成就中,我们最耳熟能详的一个则是——阿伏伽德罗常数N
A。
(1)阿伏伽德罗常数的单位是
_______。
(2)阿伏加德罗常数通常由实验测定。它的测定精确度随着实验技术的发展而不断提高。测定方法有电化学当量法、布朗运动法、油滴法、X射线衍射法、黑体辐射法、光散射法等。这些方法的理论依据不同,但测定结果几乎一样,可见阿伏加德罗常数是客观存在的重要常数。
①阅读以下实验过程,写出此时阿伏伽德罗常数测量时使用的表达式:
_______。(可以使用下文出现的字母,每个电子的电荷量是C,I=Q(电量,物体所带的电荷量)/t,下同)
向一只洁净的空试管中倒入 n L 浓度为c的XNO
3溶液,将与学生电源之间用导线连接的两块石墨电极放入试管中且互不接触。中间接一个电流表。打开学生电源,观察到电流表的示数恒定为I
A。一段时间t后,关闭学生电源并取出石墨电极,测得石墨电极共增重m g (0 < m << n·c),电流效率为η。已知X元素的摩尔质量为M,且X元素的单质是一种活动性次于铜的金属。
②已知硬脂酸能在水面上扩散而形成单分子层,阅读以下的实验方案,写出此时阿伏伽德罗常数测量时使用的表达式:
_______。
实验步骤:
1.测定从胶头滴管滴出的每滴硬脂酸的苯溶液的体积
取一尖嘴拉得较细的胶头滴管,吸入硬脂酸的苯溶液,往小量筒中滴入 1mL,然后记下它的滴数,并计算出 1滴硬脂酸苯溶液的体积V
1。
2.测定水槽中水的表面积
用直尺从三个不同方位准确量出水槽的内径,取其平均值。
3.硬脂酸单分子膜的形成
用胶头滴管(如滴管外有溶液,用滤纸擦去)吸取硬脂酸的苯溶液在距水面约5 cm处,垂直往水面上滴一滴,待苯全部挥发,硬脂酸全部扩散至看不到油珠时,再滴第二滴。如此逐滴滴下,直到滴下一滴后,硬脂酸溶液不再扩散,而呈透镜状时为止。记下所滴硬脂酸溶液的滴数d。
4.把水槽中水倒掉,用清水将水槽洗刷干净后,注入半槽水,重复以上操作二次。重复操作时,先将滴管内剩余的溶液挤净,吸取新鲜溶液,以免由于滴管口的苯挥发引起溶液浓度的变化。取三次结果的平均值。
设称取硬脂酸的质量为m,配成硬脂酸的苯溶液的体积为V,根据水槽直径计算出水槽中水的表面积S,每个硬脂酸分子的截面积是A,硬脂酸的摩尔质量为M。
提示:当最后一滴硬脂酸溶液滴下后,这滴溶液在水面呈透镜状,说这滴溶液没有扩散,即没有参与单分子膜的形成。这时单分子膜已经形成完毕,应停止滴入溶液。
③晶胞是构成晶体的最基本的几何单元。已知某易溶于水、不溶于苯的离子化合物YZ一个晶胞中有8个离子,阅读以下在平行宇宙进行的实验过程,写出此时测得的阿伏伽德罗常数的数值:
_______。(保留5位小数)
利用X-射线衍射法测得晶胞的边长为5.64×10
-8 cm,其晶胞的结构如图所示:

同时测得YZ的摩尔质量为29.225 g/mol。
将YZ固体研细,干燥,用分析天平称取11.6885g YZ,装入25 mL容量瓶中,然后用滴定管向容量瓶中滴加已经被无水氯化钙干燥过的苯,并不断振荡,使苯与YZ充分混合,加至刻度线并静置1 min,读出滴定管此时的示数并计算出其变化量ΔV如下表:
| 次数 | 1 | 2 | 3 | 4 | 5 |
| ΔV/cm3 | 22.27 | 22.24 | 22.31 | 21.53 | 22.26 |
提示:一个YZ是由Y
a+ 和Z
b- 2个离子构成的。
 、
、 和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中
和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中 、
、 和CO的体积比为
和CO的体积比为







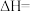
 投入一恒温密闭容器,反应达平衡时,体系的总压强为a Pa、
投入一恒温密闭容器,反应达平衡时,体系的总压强为a Pa、 的体积分数为20%,该温度下反应的平衡常数
的体积分数为20%,该温度下反应的平衡常数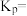

 ,到达平衡时,测得CO、
,到达平衡时,测得CO、 、
、 分别为1 mol、1 mol、1 mol,此时容器的体积为3 L,现往容器中继续通入3 mol CO,则v(正)
分别为1 mol、1 mol、1 mol,此时容器的体积为3 L,现往容器中继续通入3 mol CO,则v(正) 。已知一定条件下,该反应中CO的平衡转化率随温度、投料比
。已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图:
的变化曲线如图:

 和4.0 mol
和4.0 mol  充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中二甲醚
充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中二甲醚 的物质的量分数变化情况如上图所示,在不同温度和压强下
的物质的量分数变化情况如上图所示,在不同温度和压强下 的平衡转化率最小的是
的平衡转化率最小的是 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、






