全一卷
1.下列属于碱的是
| A.CO2 | B.H2SO4 | C.Mg(OH)2 | D.NaCl |
2.下列图示与操作名称不对应 的是
A.升华 | B.分液 |
C.过滤 | D.蒸馏 |
3.下列属于化合反应的是
| A.Zn+2AgNO3=Zn(NO3)2+2Ag | B.2FeCl2+Cl2=2FeCl3 |
| C.Cu(OH)2+2HCl=CuCl2+2H2O | D.CaCO3 CaO+CO2↑ CaO+CO2↑ |
4.下列物质因发生水解而使溶液呈酸性的是
| A.HNO3 | B.CuCl2 | C.K2CO3 | D.NaCl |
5.可用于治疗胃酸过多的物质是
| A.碳酸氢钠 | B.氯化钠 | C.氯化钾 | D.氢氧化钠 |
6.下列化学反应中溴元素仅被氧化的是
| A.2NaBr+Cl2=2NaCl+Br2 | B.Br2+2NaI=2NaBr+I2 |
C.3Br2+6NaOH 5NaBr+NaBrO3+3H2O 5NaBr+NaBrO3+3H2O | D.HBr+NaOH=NaBr+H2O |
7.下列表示不正确 的是
A.Na+ 结构示意图 | B.乙烷的比例模型 |
| C.乙醛的结构简式CH3CHO | D.氯化钙的电子式 |
8.下列说法不正确的是
| A.电解熔融氯化镁可制取金属镁 |
| B.电解饱和食盐水可制取氯气 |
| C.生产普通玻璃的主要原料为石灰石、纯碱和晶体硅 |
| D.接触法制硫酸的硫元素主要来源于硫黄或含硫矿石 |
9.下列说法不正确 的是
| A.乙醇、苯应密封保存,置于阴凉处,且远离火源 | B.金属钠着火时,可用细沙覆盖灭火 |
| C.有毒药品的废液须倒入指定的容器 | D.容量瓶洗净后须用酒精灯加热干燥 |
10.下列实验合理的是
| A.用湿润的pH试纸测定CH3COONa溶液的pH |
| B.用蒸馏的方法分离乙醇(沸点为78.3℃)和苯(沸点为80.1℃)的混合物 |
| C.用淀粉-KI试纸鉴别碘水和FeCl3溶液 |
| D.用Na2CO3溶液鉴别CaCl2溶液、NaCl溶液和稀硫酸 |
11.下列说法不正确的是
| A.18O和16O是质子数相同的两种核素 |
| B.戊烷的一种同分异构体可命名为2-乙基丙烷 |
| C.丙烷的一氯代物和正丁烷的一氯代物种数相同 |
| D.金刚石和石墨在氧气中完全燃烧均只生成二氧化碳气体 |
12.元素X、Y、Z和Q在周期表中的位置如图所示,其中元素Q位于第四周期,X、Y、Z原子的最外层电子数之和为17,下列说法不正确 的是
| X | |||
| Y | Z | ||
| Q |
| A.原子半径(r):r(Q)>r(Y)>r(Z) |
| B.元素X有 -4,+2、+4等多种价态 |
| C.Y、Z的氧化物对应的水化物均为强酸 |
| D.可以推测H3QO4是Q的最高价氧化物的水化物 |
13.能正确表示下列离子方程式是
| A.KI溶液久置空气中变黄色:4I-+O2+2 H2O = 2 I2+4 OHˉ |
| B.少量三氧化硫与氨水反应:SO3+NH3·H2O = NH4++HSO4- |
| C.Na与CuSO4水溶液反应:2Na+Cu2+ =Cu +2Na+ |
| D.(NH4)2SO4和FeSO4混合溶液与足量NaOH反应:Fe2++2 OHˉ= Fe(OH)2↓ |
14.已知X(g)+3Y (g) 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是| A.充分反应后,放出热量为a kJ |
| B.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2 |
| C.当X的物质的量分数不再改变,表明该反应已达平衡 |
| D.若增大Y的浓度,正反应速率增大,逆反应速率减小 |
15.下列说法不正确的是
| A.石油裂解气可以使溴水褪色,也可以使高锰酸钾溶液褪色 |
| B.可以用新制的氢氧化铜检验乙醇中是否含有乙醛 |
| C.正丙醇(CH3CH2CH2OH)和钠反应要比水和钠反应剧烈 |
D. 属于取代反应 属于取代反应 |
16.下列说法正确的是
| A.分馏石油可以得到植物油、柴油、润滑油 |
| B.在酒化酶的作用下葡萄糖水解为乙醇和二氧化碳 |
| C.乙酸、汽油、纤维素均能和氢氧化钠溶液反应 |
| D.在大豆蛋白溶液中,加入硫酸铜溶液,蛋白质会发生变性 |
17.最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确 的是


| A.右边吸附层中发生了还原反应 |
| B.负极的电极反应是H2-2e-+2OH-=2H2O |
| C.电池的总反应是2H2+O2=2H2O |
D.电解质溶液中Na+向右移动, 向左移动 向左移动 |
18.下列说法不正确 的是
| A.测得0.1 mol·L-1的一元酸HA溶液pH=3.0,则HA一定为弱电解质 |
| B.25℃时,将0.1 mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.0 |
| C.25℃时,将0.1 mol·L-1的HA溶液加水稀释至pH=4.0,所得溶液c(OH-)=1×10-10 mol·L-1 |
| D.0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合,所得溶液pH一定等于7.0 |
19.下列说法正确的是
| A.CaO与水反应过程中,有共价键的断裂和形成 |
| B.H2O的热稳定性比H2S强,是由于H2O的分子间作用力较大 |
| C.KCl、HCl、KOH的水溶液都能导电,所以它们都属于离子化合物 |
| D.葡萄糖、二氧化碳和足球烯(C60)都是共价化合物,它们的晶体都属于分子晶体 |
20.设NA为阿伏加德罗常数的值,下列说法不正确 的是
A.32 g S8(分子结构: )中的共价键数目为NA )中的共价键数目为NA |
| B.2 g由H218O和2H2O组成的物质中含有的质子数为NA |
| C.8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA |
| D.标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA |
21.已知:




下列说法正确的是




下列说法正确的是
| A.∆H1<0,∆H2<0,∆H3<∆H4 | B.6∆H1+∆H2+∆H3-∆H4=0 |
| C.-6∆H1+∆H2+∆H3-∆H4=0 | D.-6∆H1+∆H2-∆H3+∆H4=0 |
22.已知:2SO2(g)+ O2(g)= 2SO3(g) △H =-197.8kJ•mol—1。起始反应物为SO2和 O2(物质的量之比为2:1,且总物质的量不变)。SO2的平衡转化率(%)随温度和压强的变化如下表,下列说法不正确的是
| 温度/K | 压强/(105Pa) | ||||
| 1.01 | 5.07 | 10.1 | 25.3 | 50.7 | |
| 673 | 99.2 | 99.6 | 99.7 | 99.8 | 99.9 |
| 723 | 97.5 | 98.9 | 99.2 | 99.5 | 99.6 |
| 773 | 93.5 | 96.9 | 97.8 | 98.6 | 99.0 |
| A.一定压强下降低温度,SO2的转化率增大 |
| B.在不同温度、压强下,转化相同物质的量的SO2所需要的时间相等 |
| C.使用催化剂可以缩短反应达到平衡所需的时间 |
| D.工业生产通常不采取加压措施是因为常压下SO2的转化率已相当高 |
23.常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确 的是

| A.3种HCl溶液的c(HCl):最大的是最小的100倍 |
| B.曲线a、b、c对应的c(NaOH):a>b>c |
| C.当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-) |
| D.当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大 |
24.已知草酸(H2C2O4)是一种弱酸,157℃升华,170℃以上分解可放出CO2和CO;可与酸性KMnO4溶液反应;其钠盐易溶于水,钙盐难溶于水。下列说法正确的是
| A.草酸受热产生的气体,用足量的NaOH溶液充分吸收后,可收集得到纯净的CO |
| B.草酸受热产生的气体通过灼热的氧化铜,若出现黑色变红色现象,则说明产生的气体中一定有CO |
| C.草酸受热产生的气体直接通入足量的澄清石灰水中,若能产生白色浑浊现象,则说明产生的气体中一定有CO2 |
| D.H2C2O4与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |
25.通过实验得出的结论正确的是
| A.将某固体试样完全溶于盐酸,再滴加BaCl2溶液,出现白色沉淀,则该固体试样中存在SO42- |
| B.将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现血红色,则该固体试样中不存在Fe3+ |
| C.在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中仍可能存在NH4+ |
| D.在某固体试样加水后的上层清液中,滴加盐酸出现白色沉淀,再加NaOH溶液沉淀溶解,则该固体试样中存在SiO32- |
26.通过对煤的综合利用,可以获得多种有机物。化合物A含有碳、氢、氧3种元素,其质量比是12:3:8。液态烃B是一种重要的化工原料,其摩尔质量为78 g•mol-1。E是有芳香气味的酯。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
(1)化合物A所含的官能团名称是_____________ 。
(2)B和CH2=CH2反应生成C的反应类型是_____________ 。
(3)E在氢氧化钠溶液中水解的化学方程式是_____________ 。
(4)下列说法正确的是_____________ 。
A.将铜丝在空气中灼烧后迅速插入A中,反应多次,可得到能发生银镜反应的物质
B.在一定条件下,C可通过取代反应转化为
C.苯甲酸钠(常用作防腐剂)可通过D和氢氧化钠反应得到
D.共a mol的B 和D混合物在氧气中完全燃烧,消耗氧气大于7.5a mol

(1)化合物A所含的官能团名称是
(2)B和CH2=CH2反应生成C的反应类型是
(3)E在氢氧化钠溶液中水解的化学方程式是
(4)下列说法正确的是
A.将铜丝在空气中灼烧后迅速插入A中,反应多次,可得到能发生银镜反应的物质
B.在一定条件下,C可通过取代反应转化为

C.苯甲酸钠(常用作防腐剂)可通过D和氢氧化钠反应得到
D.共a mol的B 和D混合物在氧气中完全燃烧,消耗氧气大于7.5a mol
27.已知化合物X由3种元素组成,某学习小组进行了如下实验:
①取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色;
②取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和;中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀。
请回答:
(1)X中3种元素是____________ (用元素符号表示);
(2)X与水反应的化学方程式是_____________________________________________________ ;
(3)X中一种元素对应的单质,可与足量的Na2CO3溶液反应得到Cl2O,写出该反应的化学方程式:___________ 。
①取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色;
②取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和;中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀。
请回答:
(1)X中3种元素是
(2)X与水反应的化学方程式是
(3)X中一种元素对应的单质,可与足量的Na2CO3溶液反应得到Cl2O,写出该反应的化学方程式:
28.某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)。请回答:
(1)下列说法正确的是__________ 。
A.反应后,将试管Ⅰ中的白色固体加入水中,溶液呈蓝色
B.取下试管Ⅲ并不断振荡,试管中出现浑浊,是因为生成了BaSO4
C.试管Ⅳ中KMnO4溶液褪色,说明SO2具有氧化性
D.试管V中的NaOH溶液可用Na2CO3溶液代替
(2)取下试管Ⅱ,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因______________ 。

(1)下列说法正确的是
A.反应后,将试管Ⅰ中的白色固体加入水中,溶液呈蓝色
B.取下试管Ⅲ并不断振荡,试管中出现浑浊,是因为生成了BaSO4
C.试管Ⅳ中KMnO4溶液褪色,说明SO2具有氧化性
D.试管V中的NaOH溶液可用Na2CO3溶液代替
(2)取下试管Ⅱ,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因
29.某红色固体粉末可能是Fe2O3、Cu2O或二者混合物,为探究其组成,称取mg该固体粉末样品,用足量的稀H2SO4充分反应后,称得固体质量为ag。
已知:Cu2O+2H+ = Cu+Cu2++H2O
(1)若a=____________ (用含m的最简式表示),则红色固体粉末为纯净物;
(2)若a=m/9,则红色固体粉末中Fe2O3的物质的量为____________ mol(用含m的最简式表示)。
已知:Cu2O+2H+ = Cu+Cu2++H2O
(1)若a=
(2)若a=m/9,则红色固体粉末中Fe2O3的物质的量为
30.(一)合成氨工艺(流程如图1所示)是人工固氮最重要的途径。2018年是合成氨工业先驱哈伯(F·Haber)获得诺贝尔奖100周年。

N2和H2生成NH3的反应为: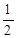 N2(g)+
N2(g)+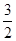 H2(g)
H2(g) NH3(g)△H(298K)=-46.2kJ·mol-1
NH3(g)△H(298K)=-46.2kJ·mol-1
在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g) 2H*
2H*
表面吸附:N*+H* NH*;NH*+H*
NH*;NH*+H* NH2*;NH2*+H*
NH2*;NH2*+H* NH3*
NH3*
脱附:NH3* NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
请回答:
(1)利于提高合成氨平衡产率的条件有_______________
A.低温B.高温C.低压D.高压E.催化剂
(2)标准平衡常数 ,其中
,其中 为标准压强1×105Pa,
为标准压强1×105Pa, 、
、 和
和 为各组分的平衡分压,如
为各组分的平衡分压,如 =
= p,p为平衡总压,
p,p为平衡总压, 为平衡系统中NH3的物质的量分数
为平衡系统中NH3的物质的量分数
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为ω,则 =
=____________ (用含ω的最简式表示)
②图中可以示意标准平衡常数K随温度T变化趋势的是____________

(3)实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8
①分析说明原料气中N2过量的理由____________
②关于合成氨工艺的下列理解,正确的是____________
A.合成氨反应在不同温度下的△H和△S都小子零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(二)高铁酸钾(K2FeO4)可用作水处理剂口某同学通过“化学一电解法”探究K2FeO4的合成,其原理如图2所示.接通电源,调节电压,将一定量C12通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4
(1)请写出“化学法”得到FeO42一的离子方程式____________
(2)请写出阳极的电极反应式(含FeO42-)____________ 

N2和H2生成NH3的反应为:
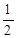 N2(g)+
N2(g)+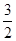 H2(g)
H2(g) NH3(g)△H(298K)=-46.2kJ·mol-1
NH3(g)△H(298K)=-46.2kJ·mol-1在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)
 2H*
2H*表面吸附:N*+H*
 NH*;NH*+H*
NH*;NH*+H* NH2*;NH2*+H*
NH2*;NH2*+H* NH3*
NH3*脱附:NH3*
 NH3(g)
NH3(g)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
请回答:
(1)利于提高合成氨平衡产率的条件有
A.低温B.高温C.低压D.高压E.催化剂
(2)标准平衡常数
 ,其中
,其中 为标准压强1×105Pa,
为标准压强1×105Pa, 、
、 和
和 为各组分的平衡分压,如
为各组分的平衡分压,如 =
= p,p为平衡总压,
p,p为平衡总压, 为平衡系统中NH3的物质的量分数
为平衡系统中NH3的物质的量分数①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为ω,则
 =
=②图中可以示意标准平衡常数K随温度T变化趋势的是

(3)实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8
①分析说明原料气中N2过量的理由
②关于合成氨工艺的下列理解,正确的是
A.合成氨反应在不同温度下的△H和△S都小子零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(二)高铁酸钾(K2FeO4)可用作水处理剂口某同学通过“化学一电解法”探究K2FeO4的合成,其原理如图2所示.接通电源,调节电压,将一定量C12通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4
(1)请写出“化学法”得到FeO42一的离子方程式
(2)请写出阳极的电极反应式(含FeO42-)

31.某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)

相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。

请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是_______________________________。②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是_______________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是_______________________________。
(3)步骤Ⅲ,合适的pH范围是_______________________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序___________________(操作可重复使用)。
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_________方式进行冷却结晶。

A.快速降温 B. 缓慢降温 C.变速降温
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
① 下列关于滴定分析,正确的是________________。
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端

B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
②图3中显示滴定终点时的度数是_____________mL。


相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
| 金属离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 1.5 | 2.8 |
| Fe2+ | 5.5 | 8.3 |
| Zn2+ | 5.4 | 8.2 |
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。

请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是_______________________________。②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是_______________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是_______________________________。
(3)步骤Ⅲ,合适的pH范围是_______________________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序___________________(操作可重复使用)。
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_________方式进行冷却结晶。

A.快速降温 B. 缓慢降温 C.变速降温
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
① 下列关于滴定分析,正确的是________________。
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端

B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
②图3中显示滴定终点时的度数是_____________mL。

32.某研究小组拟合成染料X和医药中间体Y。

已知: ;
;
请回答:
(1)下列说法正确的是____________ 。
A.化合物A能与FeCl3溶液发生显色反应 B.化合物C具有弱碱性
C.化合物F能发生加成、取代、还原反应 D.X的分子式是C17H22N2O3
(2)化合物B的结构简式是___________________________________________________ 。
(3)写出C+D→E的化学方程式_____________________________________________________ 。
(4)写出化合物A(C10H14O2)同时符合下列条件的同分异构体的结构简式_____________________________ 。
1H-NMR谱和IR谱检测表明:①分子中有4种化学环境不同的氢原子;②分子中含有苯环、甲氧基(-OCH3),没有羟基、过氧键(-O-O-)。
(5)设计以CH2=CH2和 为原料制备Y(
为原料制备Y( )的合成路线(用流程图表示,无机试剂任选)
)的合成路线(用流程图表示,无机试剂任选)
_______________ 。

已知:
 ;
;
请回答:
(1)下列说法正确的是
A.化合物A能与FeCl3溶液发生显色反应 B.化合物C具有弱碱性
C.化合物F能发生加成、取代、还原反应 D.X的分子式是C17H22N2O3
(2)化合物B的结构简式是
(3)写出C+D→E的化学方程式
(4)写出化合物A(C10H14O2)同时符合下列条件的同分异构体的结构简式
1H-NMR谱和IR谱检测表明:①分子中有4种化学环境不同的氢原子;②分子中含有苯环、甲氧基(-OCH3),没有羟基、过氧键(-O-O-)。
(5)设计以CH2=CH2和
 为原料制备Y(
为原料制备Y( )的合成路线(用流程图表示,无机试剂任选)
)的合成路线(用流程图表示,无机试剂任选) 搜索
搜索
 难度系数:0.65
难度系数:0.65  答案解析
答案解析
 有奖纠错
有奖纠错
