全一卷
1.有共价键的离子化合物是( )
A. | B. | C. | D. |
2.萃取碘水中的碘并分液,需要用到的仪器是( )
A. | B. | C. | D. |
3.下列属于有机物,又是电解质的是( )
| A.己烷 | B.乙酸 | C.葡萄糖 | D.纯碱 |
4.反应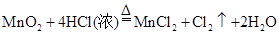 中,氧化产物是( )
中,氧化产物是( )
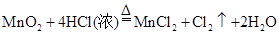 中,氧化产物是( )
中,氧化产物是( )A. | B. | C. | D. |
5.下列物质的名称不正确的是
| A.NaOH:烧碱 | B.FeSO4:绿矾 |
C. :甘油 :甘油 | D. :3−甲基己烷 :3−甲基己烷 |
6.下列表示不正确 的是
A.羟基的电子式: | B.乙烯的结构简式:CH2CH2 |
C.氯原子的结构示意图: | D.NH3分子的球棍模型: |
7.下列说法不正确 的是
| A.168O和188O互为同位素 |
| B.金刚石和石墨互为同素异形体 |
C. 和 和 互为同系物 互为同系物 |
| D.CH3COOCH2CH3和CH3CH2CH2COOH互为同分异构体 |
8.下列说法不正确的是( )
| A.二氧化硅导电能力强,可用于制造光导纤维 |
B.石灰石在高温下可用于消除燃煤烟气中的 |
| C.钠着火不能用泡沫灭火器灭火 |
| D.利用催化剂可减少汽车尾气中有害气体的排放 |
9.下列说法不正确的是( )
A. 可通过 可通过 溶液与过量氨水作用得到 溶液与过量氨水作用得到 |
B.铁锈的主要成分可表示为 |
C.钙单质可以从 中置换出 中置换出 |
D.可用 还原 还原 制备单质 制备单质 |
10.下列说法不正确的是( )
| A.天然气的主要成分甲烷是高效,较洁净的燃料 |
| B.石油的分馏、煤的气化和液化都是物理变化 |
| C.石油的裂化主要是为了得到更多的轻质油 |
| D.厨余垃圾中蕴藏着丰富的生物质能 |
11.下列有关实验说法,不正确的是( )
| A.碱液不慎溅到手上,先用大量水冲洗,再用饱和硼酸溶液洗,最后用水冲洗 |
B. 和 和 的混合物经溶解、过滤,洗涤、干燥,可分离出 的混合物经溶解、过滤,洗涤、干燥,可分离出 |
| C.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体 |
D.火柴头的浸泡液中滴加 溶液,稀 溶液,稀 和 和 溶液,可检验火柴头是否含有氯元素 溶液,可检验火柴头是否含有氯元素 |
12.下列关于铝及其化合物说法,不正确的是( )
| A.明矾可用作净水剂和消毒剂 | B.利用铝热反应可冶炼高熔点金属 |
| C.铝可用作包装材料和建筑材料 | D.氢氧化铝可用作治疗胃酸过多的药物 |
13.不能 正确表示下列变化的离子方程式是
| A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O |
| B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+ |
C.苯酚钠溶液中通入少量CO2:2 +CO2+H2O=2 +CO2+H2O=2 +CO32— +CO32— |
D.醋酸钠水解:CH3COO−+H2O CH3COOH+OH− CH3COOH+OH− |
14.下列说法不正确的是( )
| A.强酸、强碱、重金属盐等可使蛋白质变性 |
| B.用新制氢氧化铜悬浊液(必要时可加热)能鉴别甲酸、乙醇、乙醛 |
C.乙酸乙酯中混有的乙酸,可加入足量的饱和 溶液,经分液除去 溶液,经分液除去 |
| D.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚 |
15.下列关于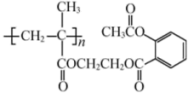 的说法,正确的是( )
的说法,正确的是( )
 的说法,正确的是( )
的说法,正确的是( )| A.该物质可由n个单体分子通过缩聚反应生成 |
B. 该物质完全燃烧,生成33.6 L(标准状况)的 该物质完全燃烧,生成33.6 L(标准状况)的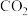 |
| C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂 |
D. 该物质与足量 该物质与足量 溶液反应,最多可消耗 溶液反应,最多可消耗 |
16.下列说法正确的是( )
| A.同一原子中,在离核较远的区域运动的电子能量较高 |
| B.原子核外电子排布,先排满K层再排L层,先排满M层再排N层 |
| C.同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大 |
| D.同一周期中,Ⅱ A与Ⅲ A族元素原子的核电荷数都相差1 |
17.下列说法不正确的是( )
A. 的溶液不一定呈碱性 的溶液不一定呈碱性 |
B.中和pH和体积均相等的氨水、 溶液,所需 溶液,所需 的物质的量相同 的物质的量相同 |
C.相同温度下,pH相等的盐酸、 溶液中, 溶液中, 相等 相等 |
D.氨水和盐酸反应后的溶液,若溶液呈中性,则 |
18.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )


| A.电极A为阳极,发生氧化反应生成氯气 |
| B.离子交换膜为阳离子交换膜 |
| C.饱和NaCl从a处进,NaOH溶液从d处出 |
| D.OH-迁移的数量等于导线上通过电子的数量 |
19.在干燥的HCl气流中加热MgCl2·6H2O,能得到无水MgCl2。下列说法不正确 的是
| A.MgCl2·nH2O(s)=MgCl2·(n-1)H2O(s)+H2O(g) ΔH>0 |
| B.MgCl2·2H2O(s)=Mg(OH)2(s)+2HCl(g),HCl气流可抑制反应进行 |
| C.MgCl2·H2O(s)=Mg(OH)Cl(s)+HCl(g),升高温度,反应更易发生 |
| D.MgCl2·4H2O(s)=MgCl2·2H2O(s)+2H2O(g),HCl气流可抑制反应进行 |
20.设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法不正确的是
A.H2(g)+ O2(g)=H2O(l) ΔH=-286 kJ·mol−1,则每1 mol [H2(g)+ O2(g)=H2O(l) ΔH=-286 kJ·mol−1,则每1 mol [H2(g)+ O2(g)]生成1 mol [H2O(l)]放热286 kJ O2(g)]生成1 mol [H2O(l)]放热286 kJ |
| B.Cr2O72-+ne−+14H+=2Cr3++7H2O,则每生成1 mol Cr3+转移电子数为3NA |
| C.Al3++4OH−=[Al(OH)4]−,说明1 mol Al(OH)3电离出H+数为NA |
| D.1 mol CO2与NaOH溶液完全反应,则n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol |
21.一定温度下,在2 L的恒容密闭容器中发生反应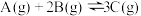 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
下列说法正确的是( )
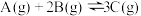 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:| n/mol t/min |  |  |  |
| 0 | 2.0 | 2.4 | 0 |
| 5 | 0.9 | ||
| 10 | 1.6 | ||
| 15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为 |
| B.该反应在10 min后才达到平衡 |
C.平衡状态时, |
| D.物质B的平衡转化率为20% |
22.在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法正确的是


A.Ea为逆反应活化能,E 为正反应活化能 为正反应活化能 |
| B.该反应为放热反应,ΔH=Ea’-Ea |
| C.所有活化分子的平均能量高于或等于所有分子的平均能量 |
| D.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移 |
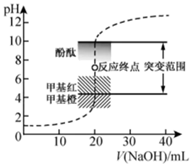
23.室温下,向 盐酸中滴加
盐酸中滴加 溶液,溶液的pH随
溶液,溶液的pH随 溶液体积的变化如图。已知
溶液体积的变化如图。已知 。下列说法不正确的是( )
。下列说法不正确的是( )
 盐酸中滴加
盐酸中滴加 溶液,溶液的pH随
溶液,溶液的pH随 溶液体积的变化如图。已知
溶液体积的变化如图。已知 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 与盐酸恰好完全反应时, 与盐酸恰好完全反应时, |
| B.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
| C.选择甲基红指示反应终点,误差比甲基橙的大 |
D. 时, 时, |
24.100%硫酸吸收 可生成焦硫酸(分子式为
可生成焦硫酸(分子式为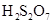 或
或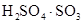 )。下列说法不正确的是( )
)。下列说法不正确的是( )
 可生成焦硫酸(分子式为
可生成焦硫酸(分子式为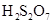 或
或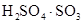 )。下列说法不正确的是( )
)。下列说法不正确的是( )| A.焦硫酸具有强氧化性 |
B. 水溶液呈中性 水溶液呈中性 |
C. 可与碱性氧化物反应生成新盐 可与碱性氧化物反应生成新盐 |
D.100%硫酸吸收 生成焦硫酸的变化是化学变化 生成焦硫酸的变化是化学变化 |
25.某固体混合物X,含有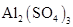 、
、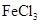 、
、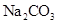 和
和 中的几种,进行如下实验:
中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与 溶液作用,无变化。
溶液作用,无变化。
下列说法不正确的是( )
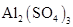 、
、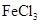 、
、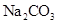 和
和 中的几种,进行如下实验:
中的几种,进行如下实验:①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与
 溶液作用,无变化。
溶液作用,无变化。下列说法不正确的是( )
A.混合物X中必定含有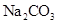 ,不含 ,不含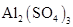 |
B.溶液Z中溶质主要是钠盐,且必含 |
| C.灼烧沉淀Y,可能得到黑色物质 |
D.往溶液Z中加入Cu粉,若不溶解,说明X中不含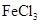 |
26.(1)比较给出 能力的相对强弱:
能力的相对强弱:
________  (填“>”“<”或“=”);用一个化学方程式说明
(填“>”“<”或“=”);用一个化学方程式说明 和
和 结合
结合 能力的相对强弱
能力的相对强弱________ 。
(2) 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出 的电子式
的电子式________ 。
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是________ 。
 能力的相对强弱:
能力的相对强弱:
 (填“>”“<”或“=”);用一个化学方程式说明
(填“>”“<”或“=”);用一个化学方程式说明 和
和 结合
结合 能力的相对强弱
能力的相对强弱(2)
 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出 的电子式
的电子式(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是
27.为测定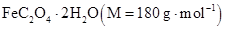 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用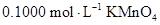 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
已知: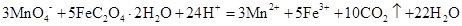
假设杂质不参加反应。
该样品中 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);
写出简要计算过程:________。
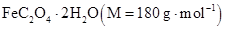 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用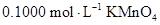 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.00 | 19.98 |
| 2 | 1.26 | 22.40 |
| 3 | 1.54 | 21.56 |
已知:
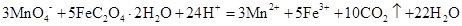
假设杂质不参加反应。
该样品中
 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);写出简要计算过程:________。
28.Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。

请回答:
(1)组成A的三种元素是________ ,A的化学式是________ 。
(2)固体A与足量稀盐酸反应的化学方程式是________ 。
(3)气体E与甲醛在一定条件下可生成乌洛托品(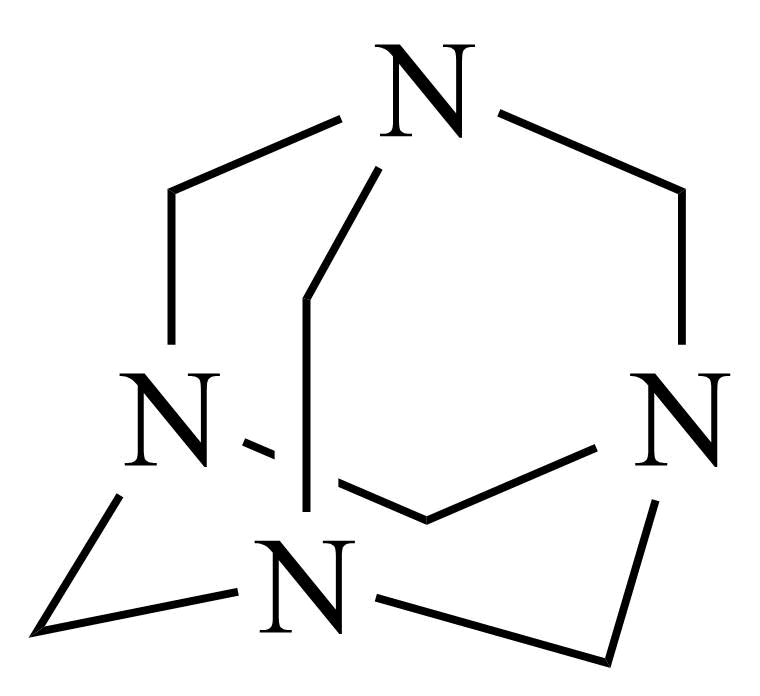 学名:亚甲基四胺),该反应的化学方程式是
学名:亚甲基四胺),该反应的化学方程式是________ (乌洛托品可以用分子式表示)。
Ⅱ.某兴趣小组为探究H2S和Cl2O的性质,将两种气体同时通入水中,实验装置如图:
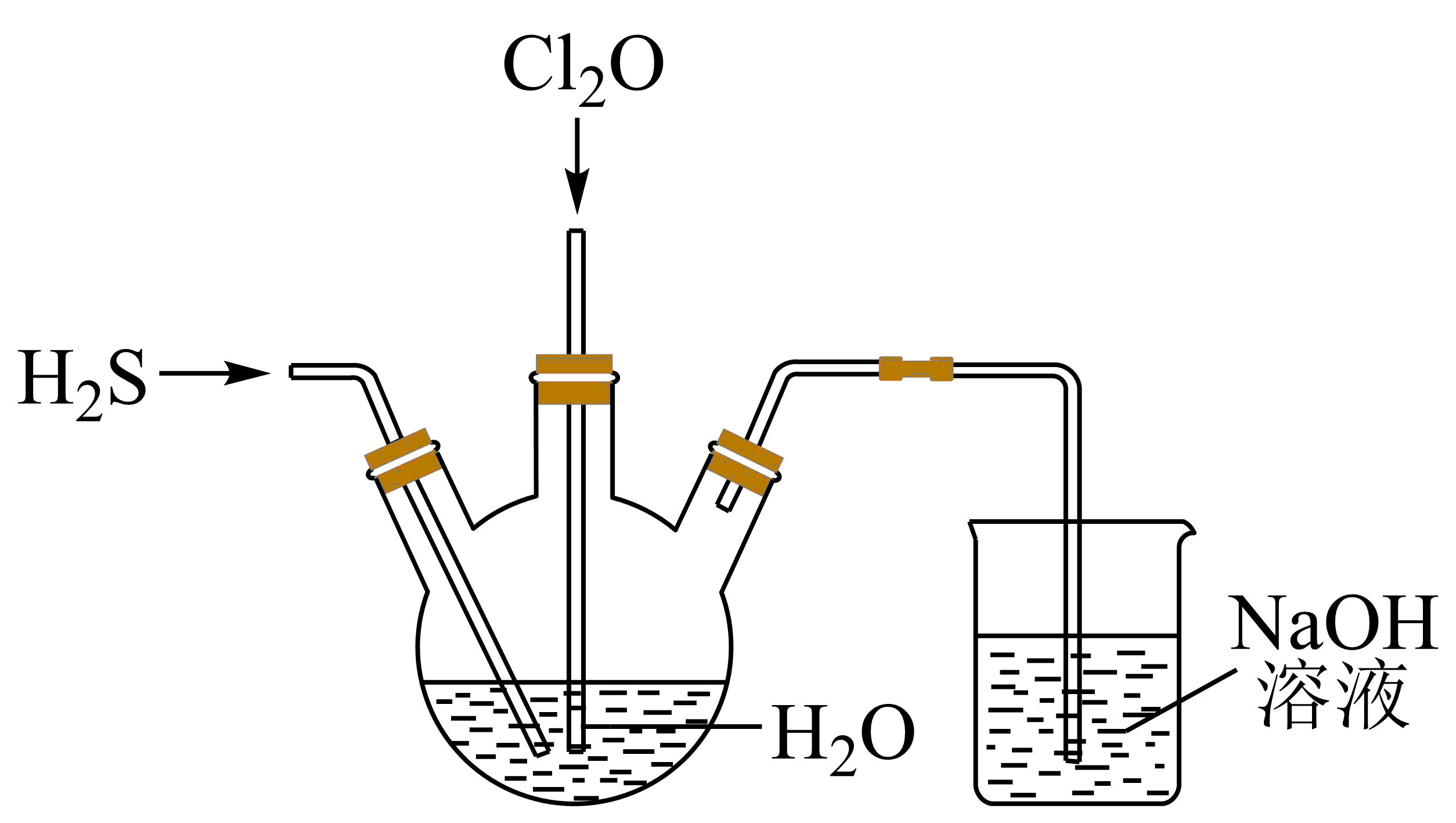
请回答:
(1) 三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示________ 。
(2) 若通入水中的Cl2O已过量,设计实验方案检验________ 。

请回答:
(1)组成A的三种元素是
(2)固体A与足量稀盐酸反应的化学方程式是
(3)气体E与甲醛在一定条件下可生成乌洛托品(
 学名:亚甲基四胺),该反应的化学方程式是
学名:亚甲基四胺),该反应的化学方程式是Ⅱ.某兴趣小组为探究H2S和Cl2O的性质,将两种气体同时通入水中,实验装置如图:

请回答:
(1) 三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示
(2) 若通入水中的Cl2O已过量,设计实验方案检验
29.研究NOx之间的转化具有重要意义。
(1)已知:N2O4(g) 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
①下列可以作为反应达到平衡的判据是________ 。
A.气体的压强不变 B.v正(N2O4)=2v逆(NO2) C.K不变 D.容器内气体的密度不变 E.容器内颜色不变
②t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g) 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=________ (对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③反应温度T1时,c(N2O4)随t(时间)变化曲线如图,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线________ 。
(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,其反应过程能量变化示意图如图。
Ⅰ 2NO(g)=N2O2(g) ΔH1
Ⅱ N2O2(g)+O2(g)→2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是________ (填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____ (填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因____ 。
(1)已知:N2O4(g)
 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。①下列可以作为反应达到平衡的判据是
A.气体的压强不变 B.v正(N2O4)=2v逆(NO2) C.K不变 D.容器内气体的密度不变 E.容器内颜色不变
②t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g)
 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=③反应温度T1时,c(N2O4)随t(时间)变化曲线如图,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线

(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,其反应过程能量变化示意图如图。

Ⅰ 2NO(g)=N2O2(g) ΔH1
Ⅱ N2O2(g)+O2(g)→2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度

30.碘化锂( )在能源、医药等领域有重要应用,某兴趣小组制备
)在能源、医药等领域有重要应用,某兴趣小组制备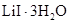 和
和 ,流程如下:
,流程如下:

已知: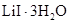 在75~80℃转变成
在75~80℃转变成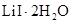 ,80~120℃转变成
,80~120℃转变成 ,300℃以上转变成无水
,300℃以上转变成无水 。
。
b. 易溶于水,溶解度随温度升高而增大。
易溶于水,溶解度随温度升高而增大。
c. 在空气中受热易被氧化。
在空气中受热易被氧化。
请回答:
(1)步骤II,调 ,为避免引入新的杂质,适宜加入的试剂为________。
,为避免引入新的杂质,适宜加入的试剂为________。
(2)步骤III,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作。
下列说法正确的是________。
A.为得到较大的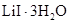 晶体颗粒,宜用冰水浴快速冷却结晶
晶体颗粒,宜用冰水浴快速冷却结晶
B.为加快过滤速度,得到较干燥的晶体,可进行抽滤
C.宜用热水洗涤
D.可在80℃鼓风干燥
(3)步骤IV,脱水方案为:将所得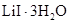 置入坩埚中,300℃加热,得
置入坩埚中,300℃加热,得 样品。用沉淀滴定法分别测定所得
样品。用沉淀滴定法分别测定所得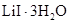 、
、 样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调
样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调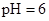 ,用滴定管中的
,用滴定管中的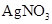 标准溶液滴定至终点,根据消耗的
标准溶液滴定至终点,根据消耗的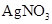 标准溶液体积计算,得
标准溶液体积计算,得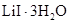 、
、 的纯度分别为99.96%,95.38%。
的纯度分别为99.96%,95.38%。 纯度偏低。
纯度偏低。
①上述测定过程提及的下列仪器,在使用前一定不能润洗的是________。
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②测定过程中使用到移液管,选出其正确操作并按序列出字母:
蒸馏水洗涤→待转移溶液润洗→________→_______→_______→_______→洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液设备
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
③ 纯度偏低,可能的主要杂质是________。
纯度偏低,可能的主要杂质是________。
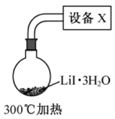
(4)步骤IV,采用改进的实验方案(装置如图),可以提高 纯度。
纯度。
①设备X的名称是________。
②请说明采用该方案可以提高 纯度的理由________。
纯度的理由________。
 )在能源、医药等领域有重要应用,某兴趣小组制备
)在能源、医药等领域有重要应用,某兴趣小组制备 和
和 ,流程如下:
,流程如下:
已知:
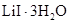 在75~80℃转变成
在75~80℃转变成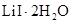 ,80~120℃转变成
,80~120℃转变成 ,300℃以上转变成无水
,300℃以上转变成无水 。
。b.
 易溶于水,溶解度随温度升高而增大。
易溶于水,溶解度随温度升高而增大。c.
 在空气中受热易被氧化。
在空气中受热易被氧化。请回答:
(1)步骤II,调
 ,为避免引入新的杂质,适宜加入的试剂为________。
,为避免引入新的杂质,适宜加入的试剂为________。(2)步骤III,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作。
下列说法正确的是________。
A.为得到较大的
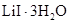 晶体颗粒,宜用冰水浴快速冷却结晶
晶体颗粒,宜用冰水浴快速冷却结晶B.为加快过滤速度,得到较干燥的晶体,可进行抽滤
C.宜用热水洗涤
D.可在80℃鼓风干燥
(3)步骤IV,脱水方案为:将所得
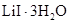 置入坩埚中,300℃加热,得
置入坩埚中,300℃加热,得 样品。用沉淀滴定法分别测定所得
样品。用沉淀滴定法分别测定所得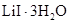 、
、 样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调
样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调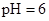 ,用滴定管中的
,用滴定管中的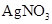 标准溶液滴定至终点,根据消耗的
标准溶液滴定至终点,根据消耗的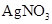 标准溶液体积计算,得
标准溶液体积计算,得 、
、 的纯度分别为99.96%,95.38%。
的纯度分别为99.96%,95.38%。 纯度偏低。
纯度偏低。①上述测定过程提及的下列仪器,在使用前一定不能润洗的是________。
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②测定过程中使用到移液管,选出其正确操作并按序列出字母:
蒸馏水洗涤→待转移溶液润洗→________→_______→_______→_______→洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液设备
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
③
 纯度偏低,可能的主要杂质是________。
纯度偏低,可能的主要杂质是________。
(4)步骤IV,采用改进的实验方案(装置如图),可以提高
 纯度。
纯度。①设备X的名称是________。
②请说明采用该方案可以提高
 纯度的理由________。
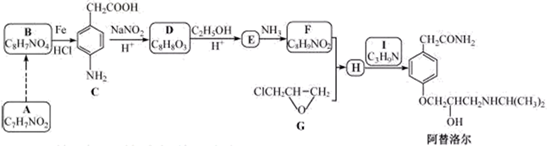
纯度的理由________。31.某研究小组以芳香族化合物A为起始原料,按下列路线合成高血压药物阿替洛尔。
已知:化合物H中除了苯环还有其它环
 :
:
请回答:
(1)下列说法正确的是________ 。
A.化合物D能发生加成,取代,氧化反应,不发生还原反应
B.化合物E能与 溶液发生显色反应
溶液发生显色反应
C.化合物1具有弱碱性
D.阿替洛尔的分子式是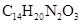
(2)写出化合物E的结构简式________ 。
(3)写出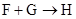 的化学方程式
的化学方程式________ 。
(4)设计从A到B的合成路线(用流程图表示,无机试剂任选)________ 。
(5)写出化合物C同时符合下列条件的同分异构体的结构简式________ 。
①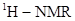 谱和IR谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键;
谱和IR谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键;
②除了苯环外无其他环。

已知:化合物H中除了苯环还有其它环
 :
:
请回答:
(1)下列说法正确的是
A.化合物D能发生加成,取代,氧化反应,不发生还原反应
B.化合物E能与
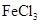 溶液发生显色反应
溶液发生显色反应C.化合物1具有弱碱性
D.阿替洛尔的分子式是
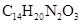
(2)写出化合物E的结构简式
(3)写出
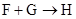 的化学方程式
的化学方程式(4)设计从A到B的合成路线(用流程图表示,无机试剂任选)
(5)写出化合物C同时符合下列条件的同分异构体的结构简式
①
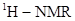 谱和IR谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键;
谱和IR谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键;②除了苯环外无其他环。
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
