
A.向盐酸中滴加 溶液 溶液 |
B.向 溶液中滴加 溶液中滴加 溶液 溶液 |
C.向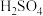 和 和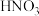 物质的量 物质的量 的混合稀酸溶液中逐渐加入 的混合稀酸溶液中逐渐加入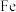 粉 粉 |
D.向 和 和 物质的量 物质的量 的混合溶液中通入 的混合溶液中通入 |
 与空气中的
与空气中的 保持平衡。某温度下,溶洞水体中
保持平衡。某温度下,溶洞水体中 (X为
(X为 、
、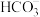 、
、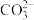 或
或 )与pH关系如图所示:
)与pH关系如图所示:
 随pH变化关系的斜线是
随pH变化关系的斜线是 的电离平衡常数
的电离平衡常数
 ;
; 时溶液的pH=
时溶液的pH=


 ;
; 溶液V mL,用0.1
溶液V mL,用0.1 氨水标准溶液进行滴定,先生成白色
氨水标准溶液进行滴定,先生成白色 沉淀,继续滴加氨水,沉淀恰好溶解生成
沉淀,继续滴加氨水,沉淀恰好溶解生成 时,消耗标准液20mL。若向该
时,消耗标准液20mL。若向该 溶液加入
溶液加入 固体,当
固体,当 开始沉淀时,溶液中
开始沉淀时,溶液中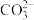 浓度为
浓度为 。[用含V的代数式表示,不考虑杂质反应]
。[用含V的代数式表示,不考虑杂质反应]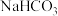 含量的方法:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,用c
含量的方法:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,用c 盐酸标准液采用“双指示剂法”滴定,先用酚酞作指示剂,到达终点a后,又滴加几滴甲基橙作指示剂,继续滴加到终点b。pH传感器测得混合溶液的pH变化曲线如图。
盐酸标准液采用“双指示剂法”滴定,先用酚酞作指示剂,到达终点a后,又滴加几滴甲基橙作指示剂,继续滴加到终点b。pH传感器测得混合溶液的pH变化曲线如图。
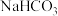 质量分数的计算式为:
质量分数的计算式为:  、
、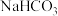 混合在密闭容器中加热至250℃充分反应,排出气体。冷却后称固体重为
混合在密闭容器中加热至250℃充分反应,排出气体。冷却后称固体重为 .下列说法正确的是
.下列说法正确的是A. 的质量比 的质量比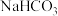 的少 的少 | B. 的物质的量比 的物质的量比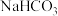 的少 的少 |
C. 的物质的量比 的物质的量比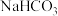 的多 的多 | D. 的物质的量与 的物质的量与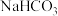 的一样多 的一样多 |
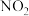 混合气体,请写出当NO、
混合气体,请写出当NO、 被
被 溶液完全吸收的离子方程式
溶液完全吸收的离子方程式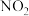 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深,若在密闭容器中达平衡改变外界条件再次平衡新平衡时,
,上述反应达到平衡后,升高温度可使体系颜色加深,若在密闭容器中达平衡改变外界条件再次平衡新平衡时, 比原平衡大了,则改变的条件可能是_______。
比原平衡大了,则改变的条件可能是_______。A.容器容积和温度不变,充入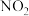 | B.容器容积和温度不变,充入 |
C.容器温度和压强不变,充入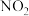 | D.容器温度和压强不变的,充入 |
 ,该反应正反应速率方程为
,该反应正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应速率常数。则图中(
分别为正、逆反应速率常数。则图中( 表示速率常数的对数;
表示速率常数的对数; 表示温度的倒数)所示的①②③④四条斜线中。能表示
表示温度的倒数)所示的①②③④四条斜线中。能表示 正随
正随 变化的斜线是
变化的斜线是 、
、 、
、 、
、 ,则在温度
,则在温度 下,某时刻恒容密闭容器中
下,某时刻恒容密闭容器中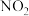 、
、 的浓度均为
的浓度均为 ,此时
,此时
 。(填大于、等于或小于)
。(填大于、等于或小于)

 分两步进行:
分两步进行:
 快反应
快反应
 慢反应
慢反应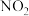 的反应随温度的升高速率减慢,其原因是
的反应随温度的升高速率减慢,其原因是 的反应过程—能量示意图
的反应过程—能量示意图
A.向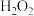 溶液中滴加少量 溶液中滴加少量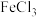 溶液: 溶液: |
B. 溶液中滴加稀氨水: 溶液中滴加稀氨水: |
C.使用 溶液检验 溶液检验 : : |
D.将等浓度的 溶液与 溶液与 溶液按体积比1∶2混合: 溶液按体积比1∶2混合: |
 浓度均为
浓度均为 的
的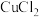 和
和 溶液中滴加
溶液中滴加 的
的 溶液,滴加过程中溶液中
溶液,滴加过程中溶液中 代表
代表 或
或 溶液体积(V)的关系如图所示[已知:
溶液体积(V)的关系如图所示[已知: 。下列有关说法正确的是
。下列有关说法正确的是
| A.d点纵坐标小于33.9 |
B. 的 的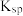 为 为 |
C.溶液的 |
D.a点的 溶液中: 溶液中: |
 时,
时, 的电离常数:
的电离常数: ,
, ,下列说法中正确的是
,下列说法中正确的是A. 溶液中: 溶液中: |
B. 溶液中: 溶液中: |
C.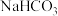 和 和 混合液中: 混合液中: |
D. 溶液与 溶液与 溶液中 溶液中 之比小于5 之比小于5 |
 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )容器1 | 容器2 | 容器3 | |
| 应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
| 平衡v正(SO2)/mol•L-1•S-1 | v1 | v2 | v3 |
| 平衡c(SO3)/mol•L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
| A. v1< v2,c2<2c1 | B. K1> K3,p2>2p3 |
| C.v1< v3,α1(SO2 ) <α2(SO3 ) | D. c2>2c3,α2(SO3 )+α3(SO2 )<1 |
步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
I | 2NO(g)⇌N2O2(g)(快) | Ea1 | v1正=k1·c2(NO) | v1逆=k2·c(N2O2) |
II | N2O2(g)+O2(g)⇌2NO2(g)(慢) | Ea2 | v2正=k3·c(N2O2)·c(O2) | v2逆=k4·c2(NO2) |


| 操作 | 现象 | |
| 甲 | 向装置I的锥形瓶中加入MnO2固体,向装置I的 | 装置I中产生无色气体并伴随大量白雾;装置III中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向装置II中加入KMnO4固体,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液不变蓝 |
| 丙 | 向装置II中加入 | 装置III中有气泡冒出,溶液变蓝 |