 是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题: 的价层电子排布式为
的价层电子排布式为 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋量子数。对于基态S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态S原子,其价电子自旋磁量子数的代数和为 ,判断该两种含氧酸酸性强弱并分析原因
,判断该两种含氧酸酸性强弱并分析原因 可得到配合物A,结构如图所示。
可得到配合物A,结构如图所示。
 氨基乙酸钠含有
氨基乙酸钠含有 键的数目为
键的数目为 (式量为
(式量为 )的晶胞结构如图a所示,阿伏加德罗常数为
)的晶胞结构如图a所示,阿伏加德罗常数为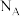 ,则
,则 晶体的密度为
晶体的密度为 (列计算式),图b为
(列计算式),图b为 原子沿z轴方向向
原子沿z轴方向向 平面投影的位置,在图b中画出S原子在该方向的投影位置
平面投影的位置,在图b中画出S原子在该方向的投影位置
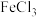 溶液与
溶液与 溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。
溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。| 推测可能发生的反应 | 推测依据 | 预期的实验现象 |
| ①氧化还原反应 |  具有一定的氧化性, 具有一定的氧化性, 具有较强的还原性 具有较强的还原性 | 若 过量,则有淡黄色沉淀(S)生成若 过量,则有淡黄色沉淀(S)生成若 过量,则有黑色沉淀 过量,则有黑色沉淀 |
| ②复分解反应 |  为黑色难溶物, 为黑色难溶物, | 有黑色固体生成 |
| ③彻底双水解反应 |  、 、 水解能力均较强 水解能力均较强 | 有 )产生,同时有臭鸡蛋气味的气体(H2S)生成 )产生,同时有臭鸡蛋气味的气体(H2S)生成 |
 与
与 能否发生反应①,设计装置如下图,能证明反应已经发生的现象有
能否发生反应①,设计装置如下图,能证明反应已经发生的现象有 ]。
]。
 与
与 能否发生反应②和③,设计如下实验:
能否发生反应②和③,设计如下实验:| 实验步骤 | 实验现象 | 实验解释或结论 |
ⅰ.向 饱和 饱和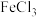 溶液中,滴加2滴饱和 溶液中,滴加2滴饱和 溶液 溶液 | 有黑色沉淀生成,而后黑色沉淀消失,出现淡黄色沉淀 | 用离子方程式解释黑色沉淀消失的原因: |
ⅱ.将 饱和 饱和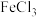 溶液与 溶液与 饱和 饱和 溶液直接混合 溶液直接混合 | 先有黑色和另一种颜色的沉淀生成,而后都变为黑色;同时有臭鸡蛋气味的气体生成 | 试解释:沉淀最终都变为黑色的原因是 |
ⅲ.取ⅱ中最终生成的黑色沉淀样品,用无水乙醇多次洗涤后,干燥称量得 黑色固体,然后在空气中灼烧至恒重 黑色固体,然后在空气中灼烧至恒重 | 灼烧后,所得红棕色固体质量为 | 经计算判断,黑色固体样品的成份为 |
 与
与 在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。  )是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。
)是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。 的制备。制备原理为:
的制备。制备原理为: 。
。 之前,混合溶液呈碱性的主要原因是:
之前,混合溶液呈碱性的主要原因是: ,
, ,能否过量
,能否过量 的操作方法:
的操作方法: 与金属阳离子的反应。
与金属阳离子的反应。 (紫黑色)
(紫黑色) 为白色沉淀,
为白色沉淀, 可溶于过量的
可溶于过量的 溶液
溶液| 装置 | 编号 | 试剂X | 实验现象 |
 | ① |  溶液 溶液 | 混合后溶液先变成紫黑色, 后溶液几乎变为无色 后溶液几乎变为无色 |
| ② |  溶液 溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
 被
被 还原为
还原为 。该反应的离子方程式:
。该反应的离子方程式: 和
和 反应。
反应。| 装置 | 编号 | 试剂X | 实验现象 |
 | ③ |  溶液 溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |

 与金属离子反应的多样性与
与金属离子反应的多样性与 和
和 ,制备超导材料TiN,反应原理为
,制备超导材料TiN,反应原理为 。
。 表示,与之相反的则用
表示,与之相反的则用 表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为 |  |  | TiN | |
| 熔点/℃ | 800(分解) | -25 | 714 | 2950 |
| 沸点/℃ | 700(升华) | 136.4 | 1412 | (略) |
 属于
属于 是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为
是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为 ,但只有甲的水解产物能与草酸(HOOC-COOH)反应生成
,但只有甲的水解产物能与草酸(HOOC-COOH)反应生成 。
。 发生水解反应的化学方程式是
发生水解反应的化学方程式是 和
和 中铂的配体数分别为
中铂的配体数分别为 的原因:
的原因: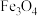 晶体中,
晶体中, 的重复排列方式如图1所示,该晶体中存在着由
的重复排列方式如图1所示,该晶体中存在着由 围成的正四面体空隙(如1、3、6、7号
围成的正四面体空隙(如1、3、6、7号 围成)和正八面体空隙(如3、6、7、8、9、12号
围成)和正八面体空隙(如3、6、7、8、9、12号 围成)。
围成)。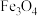 中有一半的
中有一半的 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半 和
和 分别填充在不同的正八面体空隙中,则
分别填充在不同的正八面体空隙中,则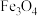 晶体中,正四面体空隙和正八面体空隙阳离子的填充率之比为
晶体中,正四面体空隙和正八面体空隙阳离子的填充率之比为
 也是红色粉末,有类似于氧化铁的用途。查阅资料可知:
也是红色粉末,有类似于氧化铁的用途。查阅资料可知: 是一种碱性氧化物,溶于稀硫酸生成
是一种碱性氧化物,溶于稀硫酸生成 和
和 ,在空气中加热生成
,在空气中加热生成 .实验室有一些红色粉末,根据来源,只知其成分可能含有氧化铁或氧化亚铜.某化学小组欲一探究竟,提出如下假设:
.实验室有一些红色粉末,根据来源,只知其成分可能含有氧化铁或氧化亚铜.某化学小组欲一探究竟,提出如下假设: ;假设2:红色粉末是
;假设2:红色粉末是 ;假设3:
;假设3: 溶液,通过现象推断其成分。请回答下列问题:
溶液,通过现象推断其成分。请回答下列问题: 试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法是否合理?
试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法是否合理? 溶液,溶液先变为红色,然后红色逐渐变浅直至消失,同时生成一种白色沉淀。为了探究白色沉淀产生的原因,同学们首先查阅资料,得知:
溶液,溶液先变为红色,然后红色逐渐变浅直至消失,同时生成一种白色沉淀。为了探究白色沉淀产生的原因,同学们首先查阅资料,得知: 是难溶于水的白色固体; ⅱ.
是难溶于水的白色固体; ⅱ. 的化学性质与
的化学性质与 的相似 ⅲ.
的相似 ⅲ. 。
。 .请你补全表格中相关内容:
.请你补全表格中相关内容:| 实验方案 | 实验现象 |
步骤1:取 的 的 ,溶液于试管中,向其中滴加3滴 ,溶液于试管中,向其中滴加3滴 溶液 溶液 | |
步骤2:取  的 的 溶液于试管中,向其中滴加3滴 溶液于试管中,向其中滴加3滴 溶液 溶液 |
 与
与 -反应的离子方程式为
-反应的离子方程式为 的质量分数,也可以判断红色粉末的成分.他们取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg,则混合物中
的质量分数,也可以判断红色粉末的成分.他们取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg,则混合物中 质量分数为
质量分数为 )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取 的流程如下:
的流程如下:
 时可认为沉淀完全
时可认为沉淀完全 如下表所示:
如下表所示:| 离子 |  | 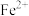 |  |
沉淀完全的 | 3.2 | 9.0 | 1.05 |
 ,
, 元素转化为
元素转化为 ,其水解反应的化学方程式是
,其水解反应的化学方程式是 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为 。
。
 为橘黄色的稳定离子,
为橘黄色的稳定离子,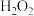 的作用是
的作用是 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是 生产甲醇,同时可减少温室气体二氧化碳,发生反应①:
生产甲醇,同时可减少温室气体二氧化碳,发生反应①:

 平衡转化率的是___________。
平衡转化率的是___________。A.在原料气中加入适量 | B.从体系中不断分离出甲醇 |
| C.循环利用原料气 | D.使用高效催化剂 |
 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的 、在
、在 下的
下的 如图所示。当
如图所示。当 的平衡转化率为
的平衡转化率为 时,反应条件可能是
时,反应条件可能是
 和
和 除发生反应①外,还发生反应②:
除发生反应①外,还发生反应②:
 。维持压强不变,按固定初始投料比将
。维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经相同时间测得实验数据:
按一定流速通过该催化剂,经相同时间测得实验数据: |  实际转化率(%) 实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
 中转化为甲醇的百分比。
中转化为甲醇的百分比。 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。

 。
。 与
与 关系的示意图
关系的示意图 )水溶液中
)水溶液中 、
、 、
、 随pH的分布如图所示:
随pH的分布如图所示:
 的第一步电离方程式为
的第一步电离方程式为 ,则:
,则:
 )
) 溶液中:
溶液中: 、
、 、
、 三种离子的物质的量浓度大小关系可表示为
三种离子的物质的量浓度大小关系可表示为 的
的 ,
, 。
。 的溶液中加入少量的
的溶液中加入少量的 溶液,反应的离子方程式为
溶液,反应的离子方程式为 溶液呈碱性是因为
溶液呈碱性是因为 发生水解,请设计实验证明
发生水解,请设计实验证明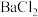 溶液)
溶液)  )在电镀、媒染等工业应用广泛,碲(
)在电镀、媒染等工业应用广泛,碲( )被誉为“国防与尖端技术的维生素”。以锡碲渣废料(主要成分为
)被誉为“国防与尖端技术的维生素”。以锡碲渣废料(主要成分为 、
、 ,还含有少量铁、砷、铅等元素的氧化物)为原料,制备锡酸钠晶体和碲的工艺流程如下:
,还含有少量铁、砷、铅等元素的氧化物)为原料,制备锡酸钠晶体和碲的工艺流程如下:
 、
、 、
、 和
和 ;
; 发生反应的离子方程式为
发生反应的离子方程式为 沉淀完全(离子浓度不大于
沉淀完全(离子浓度不大于 ),则需要加入等体积的
),则需要加入等体积的 溶液的物质的量浓度至少为
溶液的物质的量浓度至少为 )。
)。 所发生反应的化学方程式为
所发生反应的化学方程式为 碲产品,加入酸使其转化为亚碲酸
碲产品,加入酸使其转化为亚碲酸 ,将其配制成
,将其配制成 溶液,取
溶液,取 于锥形瓶中。
于锥形瓶中。 酸性
酸性 溶液,充分反应使亚碲酸转化为碲酸
溶液,充分反应使亚碲酸转化为碲酸 。
。 硫酸亚铁铵
硫酸亚铁铵 标准溶液滴定剩余的酸性
标准溶液滴定剩余的酸性 溶液,滴入几滴试亚铁灵指示剂至终点显红色,进行三次平行实验,平均消耗
溶液,滴入几滴试亚铁灵指示剂至终点显红色,进行三次平行实验,平均消耗 硫酸亚铁铵标准溶液。
硫酸亚铁铵标准溶液。 是一种可再生能源,具有广阔的开发和应用前景。一定条件下,可用合成气(
是一种可再生能源,具有广阔的开发和应用前景。一定条件下,可用合成气(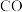 、
、 )合成甲醇:
)合成甲醇:
 回答下列问题:
回答下列问题: 有关化学键所吸收的能量数据如下表:
有关化学键所吸收的能量数据如下表:| 化学键 |  |  |  |  |  |
能量 | 436 | 462.8 | 413.4 | 1075 | 351 |

 。
。 与
与 ,恒温恒容下发生上述反应,测得平衡时
,恒温恒容下发生上述反应,测得平衡时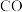 的转化率如下表:
的转化率如下表:| 实验 | 温度(℃) | 容器体积 | 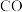 转化率 转化率 | 平衡压强 |
| Ⅰ | 200 |  | 50% |  |
| Ⅱ | 200 |  | 70% |  |
| Ⅲ | 350 |  | 50% |  |

 ”“
”“ ”或“
”或“ ”,下同)
”,下同) ;若实验Ⅱ中
;若实验Ⅱ中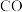 和
和 用量均加倍,则
用量均加倍,则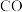 转化率
转化率
 的代数式表示)。
的代数式表示)。 和
和 反应也可以合成甲醇
反应也可以合成甲醇
 。在恒压的密闭容器中,充入一定量的
。在恒压的密闭容器中,充入一定量的 和
和 ,测得不同温度下,体系中
,测得不同温度下,体系中 的平衡转化率与压强的关系曲线如图所示。
的平衡转化率与压强的关系曲线如图所示。
 与
与 的大小关系:
的大小关系:
 ”“
”“ ”或“
”或“ ”)
”) 。
。 和
和 的条件下,向密闭容器中充入
的条件下,向密闭容器中充入 和
和 ,反应达到平衡时,容器的容积为
,反应达到平衡时,容器的容积为 。保持
。保持 和此时容器的容积不变,再充入
和此时容器的容积不变,再充入 和
和 ,设达到平衡时
,设达到平衡时 的总转化率为
的总转化率为 ,写出一个能够解出
,写出一个能够解出 的方程:
的方程: