
| A.4min时降低温度,10min时充入Cl2,14min时增大容器的体积 |
| B.平衡常数K2min<K9min<K13min |
| C.4min~8min COCl2平均反应速率为0.01mol(L·min) |
| D.若T℃时,起始向2L的恒容密闭容器中充入COCl2、Cl2、CO均为0.20 mol,则达到平衡前,v正>v逆 |


| A.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2 |
| B.A点溶液中的溶质为FeSO4和H2SO4 |
C.原混合酸中NO 和SO 和SO 物质的量之比为2:1 物质的量之比为2:1 |
| D.原混合酸中H2SO4的物质的量浓度为2mol·L-1 |

 经过“途径I”的除砷过程可描述为
经过“途径I”的除砷过程可描述为



 传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
 和NaOH溶液的反应。
和NaOH溶液的反应。
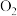 ,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是
,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是




| A.验证由C生成D后的反应混合液中还残留有C,可以采用酸性高锰酸钾溶液 |
| B.E的化学名称为3-苯基丙烯酸,1molE与足量的H2反应,最多可以消耗5molH2 |
| C.I的分子式为C20H25N2OS,F与H生成I的反应为取代反应 |
| D.C分子中最多有15个原子共平面 |
 的合成路线
的合成路线