 与
与 反应制备新型硝化剂
反应制备新型硝化剂 ,过程中涉及以下反应:
,过程中涉及以下反应:
 平衡常数
平衡常数

 平衡常数
平衡常数

 平衡常数
平衡常数
 ,
, ,
, ,其中x,y、z为常数,则反应I的活化能Ea(正)
,其中x,y、z为常数,则反应I的活化能Ea(正) 的数值范围是
的数值范围是 与
与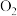 作用分别生成
作用分别生成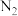 、NO、
、NO、 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为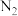 的选择性
的选择性 与温度的关系如图所示。
与温度的关系如图所示。
 的平衡转化率
的平衡转化率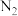 的选择性更高的催化剂,能更有效除去尾气中的
的选择性更高的催化剂,能更有效除去尾气中的 。
。 可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始时体系中气体分压
可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始时体系中气体分压 且
且 ,测得反应体系中CO和
,测得反应体系中CO和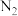 的分压随时间变化情况如表所示。
的分压随时间变化情况如表所示。| 时间/min | 0 | 30 | 60 | 120 | 180 | |
| 200℃ | 物质a的分压/kPa | 4 | 8.8 | 13 | 20 | 20 |
| 物质b的分压/kPa | 48 | 45.6 | 43.5 | 40 | 40 | |
| 300℃ | 物质a的分压/kPa | 100 | 69.0 | 48 | 48 | 48 |
| 物质b的分压/kPa | 10 | 25.5 | 36 | 36 | 36 | |

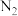 ”),200℃该反应的化学平衡常数
”),200℃该反应的化学平衡常数
 。
。 、
、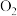 和熔融
和熔融 制成燃料电池,模拟工业电解法来精炼银,装置如下图所示。
制成燃料电池,模拟工业电解法来精炼银,装置如下图所示。

 转变成绿色硝化剂
转变成绿色硝化剂 ,可循环使用,则石墨Ⅲ附近发生的电极反应式为
,可循环使用,则石墨Ⅲ附近发生的电极反应式为
| A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O |
| B.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4 |
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O FeSO4+H2O FeSO4+H2O |
| D.温度为159 ℃时固体N的化学式为FeSO4·2H2O |
 样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示:
样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示:
A.200℃时固体物质的化学式为 |
| B.胆矾晶体的最高存在温度为102℃ |
| C.实验室灼烧固体所需器材除热源外,还需要坩埚、泥三角、三脚架、坩埚钳等 |
| D.继续升高温度,当固体残留率(剩余固体质量/原始固体质量)为28.8%时,所得固体产物为黑色 |
| A.该反应的离子方程式为:5Cl2+10OH-=7Cl-+2ClO-+ClO3—+5H2O |
| B.该反应中,氧化剂与还原剂物质的量之比为5:3 |
| C.上述苛性钾溶液中含有0.3mol的KOH |
| D.反应后生成的ClO-和ClO3-两种离子在一定条件下均有氧化性 |
 ,则N2的转化率a1=
,则N2的转化率a1=
| A.pH=12的氨水和氢氧化钠溶液按体积比1∶9混合后,pH值不变 |
B.等体积、等浓度的 和 和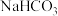 溶液混合后, 溶液混合后, |
C.用氢氧化钠标准溶液滴定稀磷酸,使用甲基橙作为指示剂,则达到滴定终点所得溶液中 |
D.等浓度的氨水和硫酸按体积比3∶1混合后溶液显碱性,则混合溶液 |
 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
| A.由图可推知:25℃,0.1 mol/L NaR溶液的pH约为10 |
| B.当通入0.1 mol NH3时,所得溶液中:c(NH4+)>c(R-)>c(OH-)>c(H+) |
| C.pH=7时,所得溶液中:c(HR)>c(R-) =c(NH4+) |
| D.pH=10时,所得溶液中:c(R-)>c(HR) ,c(NH4+)>c(NH3·H2O) |
| A.同温度同物质的量浓度时,HF比HCN易电离,NaF溶液的pH比NaCN溶液大 |
B.0.2 mol•L﹣1NH4Cl和0.1 mol•L﹣1 NaOH溶液等体积混合后:c(NH )>c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+) )>c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+) |
C.同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O;c(NH )由大到小的顺序是:①>②>③>④ )由大到小的顺序是:①>②>③>④ |
| D.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2﹣)+c(HS﹣)+c(OH﹣) |



 +—NH2
+—NH2
 +H2O
+H2O


