以废旧锂离子电池的正极材料[活性物质为

、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和

。

(1)预处理。将正极材料研磨成粉末后进行高温煅烧,高温煅烧的目的是
_______。
(2)浸出,将煅烧后的粉末(含

和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到

、

和硫酸的混合溶液。浸出实验中当观察到
_______,可以判断反应结束,不再滴加双氧水。

(3)制钻粉。向浸出后的溶液中加入NaOH调节pH,接着加入

可以制取单质钴粉,同时有

生成。已知不同pH时Co(II)的物种分布图如图所示。Co
2+可以和柠檬酸根离子(

)生成配合物

。

①写出pH=9时制钴粉的离子方程式:
_______。
②pH>10后所制钴粉中由于含有Co(OH)
2而导致纯度降低。若向pH>10的溶液中加入柠檬酸钠(

),可以提高钴粉的纯度,原因是
_______。
(4)请补充完整由浸取后滤液先制备

,并进一步制取

的实验方案:取浸取后滤液,
_______,得到

。[已知:

易溶于水,

难溶于水,

在空气中加热时的固体残留率(

100%)与随温度的变化如图所示。实验中需使用的试剂有:2


溶液、0.1

BaCl
2溶液)]

(5)用下列实验可以测定

的组成:
实验1:准确你取一定质量的

样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在
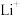
和

),冷却后转移到容量瓶中并定容至100mL。
实验2:移取25.00mL实验1容量瓶中溶液,加入指示剂,用0.01000

EDTA(

)溶液滴定至终点(滴定反应为

),平行滴定3次,平均消耗EDTA溶液25.00ml。
实验3:准确称取与实验1中等质量的

样品,加入一定量的硝酸和
溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中
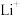
浓度为


。
计算

样品的化学式,并写出计算过程
_______。

 CH2=CH2(g)+4H2O(g) ΔH。回答下列问题:
CH2=CH2(g)+4H2O(g) ΔH。回答下列问题: +C(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
 =x]对CO2平衡转化率的影响如图所示。则∆H
=x]对CO2平衡转化率的影响如图所示。则∆H

 、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和
、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和 。
。
 和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到
和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到 、
、 和硫酸的混合溶液。浸出实验中当观察到
和硫酸的混合溶液。浸出实验中当观察到
 可以制取单质钴粉,同时有
可以制取单质钴粉,同时有 生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子(
生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子( )生成配合物
)生成配合物 。
。
 ),可以提高钴粉的纯度,原因是
),可以提高钴粉的纯度,原因是 ,并进一步制取
,并进一步制取 的实验方案:取浸取后滤液,
的实验方案:取浸取后滤液, 。[已知:
。[已知: 易溶于水,
易溶于水, 难溶于水,
难溶于水, 在空气中加热时的固体残留率(
在空气中加热时的固体残留率( 100%)与随温度的变化如图所示。实验中需使用的试剂有:2
100%)与随温度的变化如图所示。实验中需使用的试剂有:2
 溶液、0.1
溶液、0.1 BaCl2溶液)]
BaCl2溶液)]
 的组成:
的组成: 样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在
样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在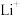 和
和 ),冷却后转移到容量瓶中并定容至100mL。
),冷却后转移到容量瓶中并定容至100mL。 EDTA(
EDTA( )溶液滴定至终点(滴定反应为
)溶液滴定至终点(滴定反应为 ),平行滴定3次,平均消耗EDTA溶液25.00ml。
),平行滴定3次,平均消耗EDTA溶液25.00ml。 样品,加入一定量的硝酸和
样品,加入一定量的硝酸和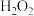 溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中
溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中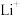 浓度为
浓度为
 。
。 样品的化学式,并写出计算过程
样品的化学式,并写出计算过程 2NH3(g) ∆H=-92.4kJ/mol)
2NH3(g) ∆H=-92.4kJ/mol)
 2NH3 ΔH=-92 kJ·mol-1
2NH3 ΔH=-92 kJ·mol-1 和酒石酸
和酒石酸 混合体系中部分物种的
混合体系中部分物种的 图(浓度:总
图(浓度:总 为
为 ,总T为
,总T为 )。下列说法错误的是
)。下列说法错误的是
 的
的 为
为
 的酸性比
的酸性比 的强
的强 时,
时, 的浓度比
的浓度比 的高
的高 时,溶液中浓度最高的物种为
时,溶液中浓度最高的物种为
 。在某体系中,
。在某体系中, 与
与 离子不能穿过隔膜,未电离的BOH可自由穿过该膜(如图所示)。设溶液中
离子不能穿过隔膜,未电离的BOH可自由穿过该膜(如图所示)。设溶液中 ,当达到平衡时,下列叙述正确的是
,当达到平衡时,下列叙述正确的是

 为
为
 相等
相等 之比为
之比为


 ),下列有机物能够合成
),下列有机物能够合成 的组合是
的组合是 2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
 2NH3(g)的平衡常数值为:
2NH3(g)的平衡常数值为: