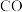 气体,Y中充满
气体,Y中充满 、
、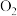 、
、 混合气体,同温同压下测得两容器中气体密度相同。下列叙述中错误的是
混合气体,同温同压下测得两容器中气体密度相同。下列叙述中错误的是| A.两容器中所含气体质量一定不同 |
| B.Y容器中所含气体原子数更多 |
C.Y容器中, 、 、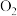 和 和 的质量比为1∶3∶3 的质量比为1∶3∶3 |
D.Y容器中所含 、 、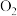 和 和 物质的量之比可能为1∶3∶6 物质的量之比可能为1∶3∶6 |
 (简写为Fc)与其氧化态(表示为Fc+)组成的电对(表示为Fc+/0)作为内标,
(简写为Fc)与其氧化态(表示为Fc+)组成的电对(表示为Fc+/0)作为内标, (对SHE)。Fc+/0电对的应用,有效解决了有机溶剂中物质的电极电势、酸碱解离常数等参数测定的问题。25℃,在水溶液(aq)和乙腈(MeCN)中得到如下数据:
(对SHE)。Fc+/0电对的应用,有效解决了有机溶剂中物质的电极电势、酸碱解离常数等参数测定的问题。25℃,在水溶液(aq)和乙腈(MeCN)中得到如下数据:| 电极反应(solv指溶剂) |  对SHE 对SHE |  对Fc+/0 对Fc+/0 |
(1) |  |  |
(2) |  |  |
(3) |  |  |
(4) |  |  |
 和
和 均为标态,反应(2)的电极电势随
均为标态,反应(2)的电极电势随 浓度发生变化:
浓度发生变化: 。在
。在
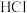 的乙腈溶液中,测得反应(2)的电极电势为
的乙腈溶液中,测得反应(2)的电极电势为 。则下列计算结果中,不正确的是
。则下列计算结果中,不正确的是A.水溶液中, 的标准电池电动势 的标准电池电动势 |
B.乙腈溶液中, 的标准电池电动势 的标准电池电动势 |
C.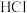 在乙腈中的解离常数 在乙腈中的解离常数 |
D.在25℃的乙腈溶液中,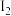 与 与 反应的平衡常数 反应的平衡常数 |
| 物质 | 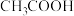 |  | HCN | HClO |  |  |
| 电离常数(K) |  |  |  |  |   |   |
 溶液②NaCN溶液③
溶液②NaCN溶液③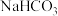 溶液④NaClO溶液;这4种溶液pH由大到小的顺序是
溶液④NaClO溶液;这4种溶液pH由大到小的顺序是 ,所发生反应的离子方程式为
,所发生反应的离子方程式为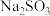 溶液中
溶液中
 。将
。将 通入氨水中,常温下,若混合溶液中
通入氨水中,常温下,若混合溶液中 mol/L时,溶液中
mol/L时,溶液中
 ,
, ]。回答下列问题:
]。回答下列问题: ,当
,当 浓度达到
浓度达到 mol/L时,废水中
mol/L时,废水中 的浓度为
的浓度为 达到平衡,该反应的平衡常数为
达到平衡,该反应的平衡常数为 ,提纯干燥后测得其熔点为144.5℃。为确定
,提纯干燥后测得其熔点为144.5℃。为确定 的组成,进行以下实验:称取0.6263g
的组成,进行以下实验:称取0.6263g ,置于特制的梨形瓶中,加入50mL 6mol L-1的盐酸,同时加入适量
,置于特制的梨形瓶中,加入50mL 6mol L-1的盐酸,同时加入适量 ,用0.1000mol L-1的碘酸钾溶液进行滴定。随着碘酸钾溶液的加入,可观察到
,用0.1000mol L-1的碘酸钾溶液进行滴定。随着碘酸钾溶液的加入,可观察到 层呈紫色,后逐渐变浅,滴至紫色褪去为终点,此时
层呈紫色,后逐渐变浅,滴至紫色褪去为终点,此时 层呈淡黄色,滴定消耗碘酸钾溶液20.00mL。在
层呈淡黄色,滴定消耗碘酸钾溶液20.00mL。在 中显黄色的物质在历史上曾被误认为
中显黄色的物质在历史上曾被误认为 。
。 是
是A. | B. | C. | D. |
 ,
, 。通过下列实验探究含硫化合物的性质。
。通过下列实验探究含硫化合物的性质。 溶液pH=4.1
溶液pH=4.1 溶液中逐滴加入5mL水,用pH计监测过程中pH变化
溶液中逐滴加入5mL水,用pH计监测过程中pH变化 溶液中逐滴加入
溶液中逐滴加入 NaOH溶液,直至pH=7
NaOH溶液,直至pH=7 中滴加10mL
中滴加10mL 溶液,产生粉色沉淀,再加几滴
溶液,产生粉色沉淀,再加几滴 溶液,产生黑色沉淀
溶液,产生黑色沉淀A.由实验1可知: 溶液中 溶液中 |
| B.实验2加水过程中,监测结果为溶液的pH不断减小 |
C.实验3所得溶液中存在: |
D.由实验4可知: |
 。起始时,
。起始时, ,
, ,
, 。在一定条件下,当反应达到平衡时,下列各物质的浓度关系可能正确的是
。在一定条件下,当反应达到平衡时,下列各物质的浓度关系可能正确的是A. |
B. |
C. |
D. |

| A.曲线c是代表HA-浓度的负对数 | B.0.01mol/LH2A的溶液,Ka2的数量级为10-4 |
| C.Z点溶液中c(Na+)>2c(A2-)+2c(OH-) | D.X点对应的pH= - (lgKa1+lgKa2) (lgKa1+lgKa2) |
 裂化可得到轻质汽油
裂化可得到轻质汽油 和
和 ,已知:
,已知:





 的
的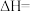
 。
。
 ,图1为相同时间内不同温度下
,图1为相同时间内不同温度下 、
、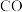 的转化率和
的转化率和 的选择性的变化情况。该反应最佳的催化剂与温度为
的选择性的变化情况。该反应最佳的催化剂与温度为
 ,温度为T℃时进行的反应为
,温度为T℃时进行的反应为 ,得到的部分数据(始表示初始物质的量、平表示平衡时的物质的量,单位均为
,得到的部分数据(始表示初始物质的量、平表示平衡时的物质的量,单位均为 )如下表:
)如下表:| 编号 | 容器类型 | 初始体积 | 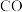 |  |  |  | ||||
| 始 | 平 | 始 | 平 | 始 | 平 | 始 | 平 | |||
| 甲 | 恒温恒容 | 2L | 2 | 2 | 0 | 1 | 0 | 0.5 | ||
| 乙 | 恒容绝热 | 2L | 2 | 2 | 0 | 0 | ||||
| 丙 | 恒温恒压 | 2L | 2 | 2 | 0 | 0 | ||||
| 丁 | 恒温恒容 | 5L | 5 | x | 5 | 0 | 0 | |||
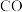 的转化率由大到小的顺序为
的转化率由大到小的顺序为 :甲
:甲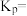
 (以分压表示,分压=总压×物质的量分数)。若平衡后再向甲容器中充入
(以分压表示,分压=总压×物质的量分数)。若平衡后再向甲容器中充入 和
和 ,则甲容器中平衡
,则甲容器中平衡

| 共价键 | C—O | N—H | C—N | C—H |
| E/(kJ/mol) | a | b | c | d |

 。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数
。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数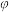 (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:
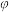 (CH3OH)=10%,该温度下反应的平常数KP=
(CH3OH)=10%,该温度下反应的平常数KP= ,此时
,此时
 的结构图
的结构图 ,则B原子的配位数是
,则B原子的配位数是| 物质 | Li2S | LiBF4 |
| 熔点/℃ | 938 | 300 |
 位于体心,则Li+位于
位于体心,则Li+位于 间的最近距离为apm,则晶体密度为
间的最近距离为apm,则晶体密度为 位于顶点,则S2-位于
位于顶点,则S2-位于