 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因 中碳原子的杂化类型是
中碳原子的杂化类型是 ,铜与M形成化合物的晶胞如图所示。
,铜与M形成化合物的晶胞如图所示。
 ,则F原子的坐标参数为
,则F原子的坐标参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为
| A.曲线①表示溶液中pH的变化 |
| B.整个过程中,水的电离程度逐渐减小 |
C.a点溶液中:c(H+)=2c( )+c( )+c( )+c(OH-) )+c(OH-) |
D.pH=10.3时:c(Na+)>3c( )+2c(ClO-)+c(HClO) )+2c(ClO-)+c(HClO) |
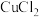 溶液和
溶液和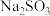 溶液的反应物,开展如下活动。
溶液的反应物,开展如下活动。预测 | 反应的离子方程式 | 实验现象 |
1 |
| 生成绿色沉淀 |
2 |
| ________ |
3 |
| 生成红色沉淀 |
4 | ________ | 生成白色沉淀( |
实验1 |
|
| 立即生成橙黄色沉淀, |
|
 ,设计实验如下。
,设计实验如下。
 在水中呈无色。实验2总反应的离子方程式为
在水中呈无色。实验2总反应的离子方程式为 ,进一步实验所需的试剂为
,进一步实验所需的试剂为 。在实验1获得橙黄色沉淀后,立即离心分离并洗涤。为探究其组成进行如下实验。
。在实验1获得橙黄色沉淀后,立即离心分离并洗涤。为探究其组成进行如下实验。
 。实验3能否证明橙黄色沉淀中含有
。实验3能否证明橙黄色沉淀中含有 和
和 ,结合实验现象做出判断并说明理由
,结合实验现象做出判断并说明理由 的原因可能是
的原因可能是 提高了
提高了 的氧化性,进行如下实验(已知装置中物质氧化性与还原性强弱差异越大,电压越大)。
的氧化性,进行如下实验(已知装置中物质氧化性与还原性强弱差异越大,电压越大)。装置 | 试剂a | 试剂b | 电压表读数 |
|
|
|
|
| X |
|
 与
与 发生复分解反应速率较快,发生氧化还原反应趋势更大。
发生复分解反应速率较快,发生氧化还原反应趋势更大。  和
和 ,起始压强为
,起始压强为 时,发生下列反应生成水煤气:
时,发生下列反应生成水煤气:

 的体积分数可能大于
的体积分数可能大于
 的转化率为
的转化率为 ,CO的物质的量为
,CO的物质的量为 。此时,整个体系
。此时,整个体系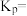
 方法的示意图如下:
方法的示意图如下:
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
 的
的 );
); 的离子方程式为
的离子方程式为 电催化还原为
电催化还原为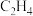 ,阴极反应式为
,阴极反应式为 制甲醇具有重要意义。其过程可能发生的反应如下:
制甲醇具有重要意义。其过程可能发生的反应如下:




 平衡产率的条件是_______。
平衡产率的条件是_______。| A.使用催化剂 | B.调整 和 和 的投料比由1∶1至1∶3 的投料比由1∶1至1∶3 |
| C.增大反应物总压 | D.通入稀有气体 |
 和
和 ,反应
,反应 后,
后, 转化率
转化率 、
、 产率
产率 及
及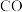 产率
产率 随温度变化曲线如图。
随温度变化曲线如图。
 先升高后降低的原因是
先升高后降低的原因是 (认为此时只发生反应1),
(认为此时只发生反应1), ,气体总体积为
,气体总体积为 ,则该温度下反应1的平衡常数
,则该温度下反应1的平衡常数

 ,
, ,则反应2的平衡常数
,则反应2的平衡常数
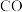 能否发生反应3存在争议。科学家利用
能否发生反应3存在争议。科学家利用 模拟
模拟 催化剂表面合成
催化剂表面合成 的两种不同路径,其决速步及活化能
的两种不同路径,其决速步及活化能 分别如下。
分别如下。
 路径2
路径2
 降低的原因是
降低的原因是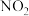 与
与 反应制备新型硝化剂
反应制备新型硝化剂 ,过程中涉及以下反应:
,过程中涉及以下反应:






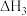

 ,
, ,
, ,其中x、y、z为常数,则反应I的活化能
,其中x、y、z为常数,则反应I的活化能 (正)
(正) (逆)(填“>”或“<”),
(逆)(填“>”或“<”), 的数值范围是
的数值范围是 B.
B. ~0 C.0~2 D.>2
~0 C.0~2 D.>2 与
与 重整是
重整是 利用的研究热点之一。该重整反应体系有以下反应:
利用的研究热点之一。该重整反应体系有以下反应:




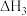 (只在高温下自发进行)
(只在高温下自发进行) 和
和 通入重整反应器中,平衡时,
通入重整反应器中,平衡时, 、
、 的物质的量分数及转化率随温度变化的关系如图所示。平衡时
的物质的量分数及转化率随温度变化的关系如图所示。平衡时 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是
 和
和 按物质的量之比为1∶1充入密闭容器中,分别在无催化剂和
按物质的量之比为1∶1充入密闭容器中,分别在无催化剂和 催化下反应相同时间,所得
催化下反应相同时间,所得 的转化率与温度的关系如图所示。a点
的转化率与温度的关系如图所示。a点 转化率相等的原因是
转化率相等的原因是
 为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为kPa)除以标准压强
为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为kPa)除以标准压强 ]。某温度下反应Ⅲ的
]。某温度下反应Ⅲ的 ,向恒容密闭容器中按
,向恒容密闭容器中按 充入原料气,初始总压为150kPa,发生反应I、II、Ⅲ,体系达到平衡时
充入原料气,初始总压为150kPa,发生反应I、II、Ⅲ,体系达到平衡时 的分压为b kPa,则
的分压为b kPa,则 的平衡转化率为
的平衡转化率为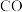 、
、 )制备二甲醚,其主要反应如下:
)制备二甲醚,其主要反应如下: ,
,
 ,
,
 ,
,
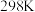 时,由稳定态单质生成
时,由稳定态单质生成 化合物的焓变称为该物质的标准摩尔生成焓
化合物的焓变称为该物质的标准摩尔生成焓 。几种物质的标准摩尔生成焓如下表所示,据此计算
。几种物质的标准摩尔生成焓如下表所示,据此计算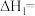
 。
。| 物质 |  |  |  |
 |  | 0.0 |  |
 ,
, 随温度变化的三种趋势如下图中线条所示。能用来表示反应ⅰ的线条是
随温度变化的三种趋势如下图中线条所示。能用来表示反应ⅰ的线条是
 催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。
催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。
 的刚性容器中充入
的刚性容器中充入 和
和 制备二甲醚,
制备二甲醚, 时达到平衡,平衡时
时达到平衡,平衡时 的转化率为80%,
的转化率为80%, ,且
,且 。
。 内,
内,
 。
。
 的反应釜中进行上述反应。初始时向反应釜中加入
的反应釜中进行上述反应。初始时向反应釜中加入 和
和 ,为确保反应的连续性,需向反应釜中以
,为确保反应的连续性,需向反应釜中以 、进气流量
、进气流量 持续通入原料,同时控制出气流量。
持续通入原料,同时控制出气流量。 ,单位时间内
,单位时间内 的转化率为60%,则流出气体中
的转化率为60%,则流出气体中 的百分含量为
的百分含量为





 (R、R1、R2为H或烃基)
(R、R1、R2为H或烃基) +2ROH
+2ROH
 +H2O
+H2O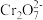 (aq) +H2O(l)
(aq) +H2O(l) 2
2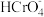 (aq) K1=3.0× 10-2(25°C);②
(aq) K1=3.0× 10-2(25°C);②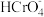 (aq)
(aq)
 (aq) +H+(aq) K2=3.3× 10-7(25°C)的条件下,25°C时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中
(aq) +H+(aq) K2=3.3× 10-7(25°C)的条件下,25°C时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中 ,随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
,随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
| A.已知Ka1(H2SO3) = 1.29× 10-2,由②可知向K2CrO4溶液中通SO2可制得KHCrO4 |
B. 的值随溶液 pH的增大逐渐减小 的值随溶液 pH的增大逐渐减小 |
C.当溶液pH=9时,溶液中的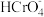 平衡浓度约为6 × 10-4mol/L 平衡浓度约为6 × 10-4mol/L |
D.当溶液pH=7时,c(K+) =c (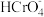 ) +c( ) +c(  ) +2c ( ) +2c (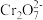 ) ) |


 (温度的倒数)的变化如图所示。据图判断,升高温度时,反应CO(g)+2H2(g)
(温度的倒数)的变化如图所示。据图判断,升高温度时,反应CO(g)+2H2(g) CH3OH(g)的化学平衡常数将
CH3OH(g)的化学平衡常数将


 ,
, ,其中
,其中 分别为正、逆反应的速率常数,1gk与
分别为正、逆反应的速率常数,1gk与 的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是
的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是 ,达到平衡时,测得体系中
,达到平衡时,测得体系中 ,以物质的分压表示的反应I的平衡常数
,以物质的分压表示的反应I的平衡常数
