
 溶液(
溶液( 为二元弱酸)中逐滴滴加0.1
为二元弱酸)中逐滴滴加0.1 二元酸
二元酸 溶液,第一个电位突跃时消耗a mL
溶液,第一个电位突跃时消耗a mL 溶液,第二个电位突跃时消耗b mL
溶液,第二个电位突跃时消耗b mL 溶液,根据消耗
溶液,根据消耗 溶液体积,可判断
溶液体积,可判断 和
和 各级电离常数大小关系。下列说法错误的是
各级电离常数大小关系。下列说法错误的是A.若a=5mL、b=5mL, 可能为强酸 可能为强酸 |
B.若a=5mL、b=15mL,则 |
C.若a=5mL、b=15mL,第一个电位突跃时,溶液中: |
D.若a=10mL、b=10mL,则用0.1  溶液滴定10mL 0.1 溶液滴定10mL 0.1  溶液,只有一个电位突跃 溶液,只有一个电位突跃 |
 ]变化如图所示。下列说法不正确的是
]变化如图所示。下列说法不正确的是
| A.常温下,H2A电离平衡常数Ka1为10-1.08 |
| B.a点时,c(HA-)+2c(H2A)>10-3.06-10-10.95 |
| C.NaHA溶液中c(Na+)>c(HA-)>c(A2-)>c(H2A) |
| D.b点时,满足c(Na+)<3c(A2-) |
 为
为 的
的 浓溶液吸收一定量的氯气,充分反应后溶液中只含有
浓溶液吸收一定量的氯气,充分反应后溶液中只含有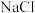 、
、 、
、 三种溶质。下列判断不正确的是
三种溶质。下列判断不正确的是A. 可能为9:4:1 可能为9:4:1 |
B.若反应中转移的电子的物质的量为 ,则 ,则 |
C.被吸收的氯气的物质的量为 |
D. 可能为14:9 可能为14:9 |
 Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
 +H+ K2
+H+ K2 +H2O
+H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
 +yH+
+yH+

 4CuO(s) △H1=-292 kJ·mol - 1
4CuO(s) △H1=-292 kJ·mol - 1 10Cu2O(s) + 3CO2(g) +4H2O(g) △H2
10Cu2O(s) + 3CO2(g) +4H2O(g) △H2 ]的关系如图所示:
]的关系如图所示:
 ]增大 ,C3H8的平衡转化率减小的原因是
]增大 ,C3H8的平衡转化率减小的原因是


 (苯胺,呈碱性,易被氧化)
(苯胺,呈碱性,易被氧化) )互为同分异构体,并具有芳香性
)互为同分异构体,并具有芳香性 的流程图(无机试剂任选)
的流程图(无机试剂任选)
A.曲线N表示pOH与 两者的变化关系 两者的变化关系 |
| B.NaHX溶液中c(X2-)>c(H2X) |
| C.当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-) |
| D.常温下,Na2X的第一步水解常数Kh1=1.0×10-4 |
 ,再与
,再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。
 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。 一段时间,目的是
一段时间,目的是 mol单质碘,发生反应:
mol单质碘,发生反应: ,量取25mL硫脲溶液加入锥形瓶,发生反应:
,量取25mL硫脲溶液加入锥形瓶,发生反应: ;
;
 ,滴加两滴淀粉溶液,用c mol·L⁻¹
,滴加两滴淀粉溶液,用c mol·L⁻¹  标准溶液滴定,发生反应:
标准溶液滴定,发生反应: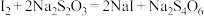 。至终点时消耗标准溶液V mL。
。至终点时消耗标准溶液V mL。
 。
。  晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。 高效光催化剂
高效光催化剂
 难溶于水,可溶于硝酸;
难溶于水,可溶于硝酸; 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能; 。
。 制备
制备 的离子反应方程式是
的离子反应方程式是 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因:
固体光催化性能极差。从速率角度解释其原因: 光催化剂的使用和再生
光催化剂的使用和再生 晶体在光照条件下发挥催化作用时,首先引发以下反应。
晶体在光照条件下发挥催化作用时,首先引发以下反应。
 光催化
光催化 制备甲醇可实现“碳中和”,a的后续反应如下。
制备甲醇可实现“碳中和”,a的后续反应如下。 ,
,
 制备甲醇的总反应的化学方程式为
制备甲醇的总反应的化学方程式为 光催化降解
光催化降解 (代表有机污染物),
(代表有机污染物), 被氧化成
被氧化成 和
和 。a的后续反应如下。
。a的后续反应如下。 ,
,
 在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。 依次降解三份相同的废水,测得3次降解过程中
依次降解三份相同的废水,测得3次降解过程中 的残留率(
的残留率( ,即时浓度与起始浓度之比)随时间变化的曲线如图。
,即时浓度与起始浓度之比)随时间变化的曲线如图。
 和
和 是降解
是降解 的重要氧化剂
的重要氧化剂 的光催化性能降低
的光催化性能降低 使用两次即基本失效
使用两次即基本失效 内的反应速率为
内的反应速率为 。(废水中
。(废水中 初始浓度
初始浓度 为
为 ,
, 的摩尔质量为
的摩尔质量为 )
)  加热脱水缩合而成。链状多聚磷酸是多个磷酸通过脱水后共有部分氧原子连接起来的,多聚磷酸根离子的部分结构投影图如图所示(由于P、O原子的半径大小不同,投影图中P与O之间存在部分或全部遮掩关系),则其化学式为
加热脱水缩合而成。链状多聚磷酸是多个磷酸通过脱水后共有部分氧原子连接起来的,多聚磷酸根离子的部分结构投影图如图所示(由于P、O原子的半径大小不同,投影图中P与O之间存在部分或全部遮掩关系),则其化学式为
 )是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:
)是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题: 的中心原子的杂化方式为
的中心原子的杂化方式为 的空间构型为
的空间构型为

 互为等电子体的分子为
互为等电子体的分子为| 物质 |  |  |  |
| 熔点/K | 256.8 | 304 | 413 |