 的
的 溶液中分别加入浓度均为
溶液中分别加入浓度均为 的
的 溶液和盐酸,混合溶液的
溶液和盐酸,混合溶液的 随所加溶液体积的变化如图所示。下列说法错误的是
随所加溶液体积的变化如图所示。下列说法错误的是
A.常温下, 的 的 |
B. 溶液中, 溶液中, |
C.N点: ;P点: ;P点: |
D.水的电离程度 |
 的转化和利用是实现碳中和的有效途径。回答下列问题。
的转化和利用是实现碳中和的有效途径。回答下列问题。 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下: ,
,
 ,
,
 ,
,

| A.混合气体的平均相对分子质量不再变化 |
| B.混合气体的密度不再变化 |
C. |
D.CO、 、 、 的物质的量之比为1∶2∶1 的物质的量之比为1∶2∶1 |
 比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时
比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:

 K时,若反应从开始到达到a点所用时间为5min,
K时,若反应从开始到达到a点所用时间为5min,
 ,反应②的
,反应②的
 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数 ,最终结果用分数表示)。
,最终结果用分数表示)。 形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是
形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是 B.
B.
 )具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。
)具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。A.吡啶中含有与苯类似的大π键 |
| B.吡啶中N原子的价层孤电子对占据2p轨道 |
C.3-甲基吡啶( )的碱性大于吡啶 )的碱性大于吡啶 |
| D.吡啶在水中的溶解度大于苯在水中的溶解度 |
 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以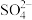 和
和 两种离子的形式存在。
两种离子的形式存在。 中N原子均为
中N原子均为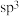 杂化,请写出
杂化,请写出 的结构式:
的结构式: 的一种流程如下:
的一种流程如下:
 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是 ,滤液中
,滤液中 的浓度为
的浓度为 、
、 、
、 }
} ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为
 配位数为
配位数为
 ,则B点铁原子的坐标为
,则B点铁原子的坐标为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为 时,
时, 溶液中
溶液中 、
、 、
、 和
和 随
随 变化(加入
变化(加入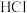 或
或 )的关系如图所示。已知:
)的关系如图所示。已知: ,
, 。下列说法正确的是
。下列说法正确的是
A. 溶液呈碱性 溶液呈碱性 |
B.图中①、③分别对应 和 和 |
C.N点时, |
D.M点时, |
 的烟气回收硫磺的工艺为:将一部分含
的烟气回收硫磺的工艺为:将一部分含 的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(
的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺( )。该工艺中涉及反应为:
)。该工艺中涉及反应为:





 的△H=
的△H=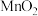 为原料,循环吸收烟气中
为原料,循环吸收烟气中 的物质转化关系如下:写出转化中由
的物质转化关系如下:写出转化中由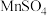 制
制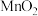 的化学反应方程式:
的化学反应方程式:
 为催化剂载体、
为催化剂载体、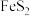 为催化剂的
为催化剂的 还原烟气中
还原烟气中 制S的反应机理如图1和如图2所示:
制S的反应机理如图1和如图2所示:

 与
与 的比例,反应相同时间,测得S的产率与温度和
的比例,反应相同时间,测得S的产率与温度和 比值的关系如图所示。500℃时,
比值的关系如图所示。500℃时,  比值为3时硫的产率小于比值为2时的原因是
比值为3时硫的产率小于比值为2时的原因是
 溶液与
溶液与 的反应。
的反应。 (经检验装置气密性良好)。
(经检验装置气密性良好)。
 的离子方程式
的离子方程式 溶液与
溶液与 的反应,过程如下图所示:
的反应,过程如下图所示:
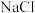 固体后产生的无色气体经检验为
固体后产生的无色气体经检验为 ,写出该检验的实验操作及现象:
,写出该检验的实验操作及现象: 溶液、
溶液、 溶液、碘水)
溶液、碘水) 固体后产生的白色沉淀经检验是
固体后产生的白色沉淀经检验是 ,说明发生了氧化还原反应。加入
,说明发生了氧化还原反应。加入 固体发生反应的原因:
固体发生反应的原因: 改变了
改变了 的还原性
的还原性 改变了的
改变了的 的氧化性
的氧化性| 编号 | 实验1 | 实验2 |
| 实验 |  |  |
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |

 与
与 的还原产物
的还原产物 形成沉淀,
形成沉淀, 与
与 的反应能够进行完全。
的反应能够进行完全。 ,短时间几乎观察不到金溶解。金易溶于“王水”[V(浓硝酸):V(浓盐酸)
,短时间几乎观察不到金溶解。金易溶于“王水”[V(浓硝酸):V(浓盐酸) ]。
]。



 + HOCH2CH2OH
+ HOCH2CH2OH
 (R1、R2为H或烃基)
(R1、R2为H或烃基)| A.①的反应类型是加成反应、消去反应 |
B.奥司他韦的分子式为 |
| C.可用溴水检验A中是否含有碳碳双键 |
| D.E易溶于水,因为其分子中的羟基、羧基能与水形成氢键 |
 谱和IR谱检测表明:
谱和IR谱检测表明: ,不含-O-O-;
,不含-O-O-; 和
和 为原料合成
为原料合成 的路线(用流程图表示,无机试剂任选)
的路线(用流程图表示,无机试剂任选)


| A.NH4Fe(SO4)2是复盐,一种特殊的混合物 |
| B.b≤0.5a时,发生的离子反应为Ba2++SO42-+ 2H++ 2OH-═BaSO4↓+2H2O |
| C.当0.5a<b≤2a时可能发生的离子反应为2H++Fe3++2Ba2++ 2SO42-+ 5OH-═2BaSO4↓+ 2Fe(OH)3↓+2H2O |
| D.当2a<b≤3a时可能发生的离子反应为NH4++ Fe3++ H++3SO42-+ 3Ba2++ 5OH-═3BaSO4↓+Fe(OH)3↓+NH3·H2O |