锰是第四周期第ⅦB族元素。锰钢异常坚硬,且具抗冲击性能,是制造枪栓、保险库、挖掘机械和铁路设施的理想材料;锰也是人体的重要微量元素。请根据所学知识,回答下列问题。
(1)锰的原子序数为
__________,基态锰原子的外围电子排布图为
__________。
(2)下列锰的化合物中,磁矩
μ=5.92的是
__________。(已知
μ=

,其中
n为金属离子核外的单电子数。)
A.KMnO
4 B.K
2MnO
4 C.MnCl
2 D.MnO
2(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与Mn
2+形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与Mn
2+形成配位键的原子有
__________;锰试剂
__________(填“能”或“不能”)形成分子内氢键。

(4)锰试剂分子中,原子采取的杂化方式不涉及
_________(填“sp”“sp
2”或“sp
3”)杂化;分子中除氢以外的元素,第一电离能从小到大的顺序为
__________(用元素符号表示)。
(5)阿拉班达石(alabandite)是一种属于立方晶系的硫锰矿,其晶胞如下左图(a)所示(●=Mn,○=S)。在该晶胞中,硫原子的堆积方式为
__________。

| 
|
图(a) | 图(b) |
(6)已知阿拉班达石晶胞中最近两个硫原子之间的距离为
d Å(1 Å=10
-10 m),晶体密度为
ρg·cm
-3,则阿伏加德罗常数的值
NA=
__________(要求化简)。
(7)为更清晰地展示晶胞中原子所在的位置,晶体化学中常将立体晶胞结构转化为平面投影图。例如沿阿拉班达石晶胞的c轴将原子投影到ab平面,即可用上右图(b)表示。下列晶体结构投影图可能表示MnS
2晶体的是
__________。


 CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1 CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2


 的一氯代物有5种
的一氯代物有5种 的一氯代物有4种
的一氯代物有4种 被还原为NO),最终溶液体积为1L。下列说法正确的是
被还原为NO),最终溶液体积为1L。下列说法正确的是 )=2.75 mol·L-1
)=2.75 mol·L-1 反应的叙述正确的为
反应的叙述正确的为 mol
mol

 ;
; 或
或 可与对氨基苯磺酸发生
可与对氨基苯磺酸发生 越大,红色越深。
越大,红色越深。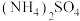 和
和 固体混合物的组成,现称取该样品四份,分别加入相同浓度的
固体混合物的组成,现称取该样品四份,分别加入相同浓度的 溶液各40.00mL,加热至120℃左右,使氨气全部逸出[
溶液各40.00mL,加热至120℃左右,使氨气全部逸出[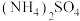 和
和 的分解温度均高于200℃],测得有关实验数据如下(标准状况):
的分解温度均高于200℃],测得有关实验数据如下(标准状况): 溶液的体积/mL
溶液的体积/mL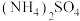 和
和 的物质的量之比(写出计算过程)
的物质的量之比(写出计算过程) 溶液的物质的量浓度(写出计算过程)
溶液的物质的量浓度(写出计算过程) )对酪氨酸酶有很强的抑制活性,在制药工程和化妆品行业有巨大的潜在应用价值。
)对酪氨酸酶有很强的抑制活性,在制药工程和化妆品行业有巨大的潜在应用价值。 


 ),Y催化环化生成Dalenin1时存在多种副产物。一种副产物Z是Dalenin1的同分异构体,也含有4个六元环,其结构简式是
),Y催化环化生成Dalenin1时存在多种副产物。一种副产物Z是Dalenin1的同分异构体,也含有4个六元环,其结构简式是 ,其中n为金属离子核外的单电子数。)
,其中n为金属离子核外的单电子数。)

 溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)
溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)