全一卷
1.我国为人类科技发展作出巨大贡献。下列成果研究的物质属于蛋白质的是
| A.陶瓷烧制 | B.黑火药 | C.造纸术 | D.合成结晶牛胰岛素 |
2.少量 与
与 反应生成
反应生成 和
和 。下列说法正确的是
。下列说法正确的是
 与
与 反应生成
反应生成 和
和 。下列说法正确的是
。下列说法正确的是A. 的电子式为 的电子式为 | B. 的空间构型为直线形 的空间构型为直线形 |
C. 中O元素的化合价为-1 中O元素的化合价为-1 | D. 仅含离子键 仅含离子键 |
3.工业上电解熔融 和冰晶石
和冰晶石 的混合物可制得铝。下列说法正确的是
的混合物可制得铝。下列说法正确的是
 和冰晶石
和冰晶石 的混合物可制得铝。下列说法正确的是
的混合物可制得铝。下列说法正确的是A.半径大小: | B.电负性大小: |
C.电离能大小: | D.碱性强弱: |
4.实验室制取少量 水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是
水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是

 水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是
水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是 
A.用装置甲制取 气体 气体 | B.用装置乙制取 水溶液 水溶液 |
C.用装置丙吸收尾气中的 | D.用干燥pH试纸检验 水溶液的酸性 水溶液的酸性 |
5.下列说法正确的是
A.金刚石与石墨烯中的 夹角都为 夹角都为 |
B. 、 、 都是由极性键构成的非极性分子 都是由极性键构成的非极性分子 |
C.锗原子( )基态核外电子排布式为 )基态核外电子排布式为 |
| D.ⅣA族元素单质的晶体类型相同 |
6.周期表中ⅣA族元素及其化合物应用广泛,甲烷具有较大的燃烧热 ,是常见燃料;Si、Ge是重要的半导体材料,硅晶体表面
,是常见燃料;Si、Ge是重要的半导体材料,硅晶体表面 能与氢氟酸(HF,弱酸)反应生成
能与氢氟酸(HF,弱酸)反应生成 (
( 在水中完全电离为
在水中完全电离为 和
和 );1885年德国化学家将硫化锗
);1885年德国化学家将硫化锗 与
与 共热制得了门捷列夫预言的类硅—锗;下列化学反应表示正确的是
共热制得了门捷列夫预言的类硅—锗;下列化学反应表示正确的是
 ,是常见燃料;Si、Ge是重要的半导体材料,硅晶体表面
,是常见燃料;Si、Ge是重要的半导体材料,硅晶体表面 能与氢氟酸(HF,弱酸)反应生成
能与氢氟酸(HF,弱酸)反应生成 (
( 在水中完全电离为
在水中完全电离为 和
和 );1885年德国化学家将硫化锗
);1885年德国化学家将硫化锗 与
与 共热制得了门捷列夫预言的类硅—锗;下列化学反应表示正确的是
共热制得了门捷列夫预言的类硅—锗;下列化学反应表示正确的是A. 与HF溶液反应: 与HF溶液反应: |
B.高温下 还原 还原 : : |
C.铅蓄电池放电时的正极反应: |
D.甲烷的燃烧: |
7.我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、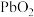 是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料,下列物质性质与用途具有对应关系的是
是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料,下列物质性质与用途具有对应关系的是
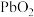 是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料,下列物质性质与用途具有对应关系的是
是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料,下列物质性质与用途具有对应关系的是| A.石墨能导电,可用作润滑剂 |
| B.单晶硅熔点高,可用作半导体材料 |
| C.青铜比纯铜熔点低、硬度大,古代用青铜铸剑 |
| D.含铅化合物颜色丰富,可用作电极材料 |
8.氮及其化合物的转化具有重要应用。下列说法不正确 的是
A.自然固氮、人工固氮都是将 转化为 转化为 |
B.侯氏制碱法以 、 、 、 、 、 、 为原料制备 为原料制备 和 和 |
C.工业上通过 催化氧化等反应过程生产 催化氧化等反应过程生产 |
| D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环” |
9.精细化学品Z是X与 反应的主产物,X→Z的反应机理如下:
反应的主产物,X→Z的反应机理如下:

下列说法不正确 的是
 反应的主产物,X→Z的反应机理如下:
反应的主产物,X→Z的反应机理如下:
下列说法
A.X与 互为顺反异构体 互为顺反异构体 |
B.X能使溴的 溶液褪色 溶液褪色 |
C.X与HBr反应有副产物 生成 生成 |
| D.Z分子中含有2个手性碳原子 |
10.用尿素水解生成的 催化还原
催化还原 ,是柴油机车辆尾气净化的主要方法。反应为
,是柴油机车辆尾气净化的主要方法。反应为 ,下列说法正确的是
,下列说法正确的是
 催化还原
催化还原 ,是柴油机车辆尾气净化的主要方法。反应为
,是柴油机车辆尾气净化的主要方法。反应为 ,下列说法正确的是
,下列说法正确的是A.上述反应 |
B.上述反应平衡常数 |
C.上述反应中消耗 ,转移电子的数目为 ,转移电子的数目为 |
| D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小 |
11.室温下,下列实验探究方案不能 达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向盛有 溶液的试管中滴加几滴 溶液的试管中滴加几滴 溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 |  具有还原性 具有还原性 |
| B | 向盛有 水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 |  具有漂白性 具有漂白性 |
| C | 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 |  的氧化性比 的氧化性比 的强 的强 |
| D | 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 |  是弱电解质 是弱电解质 |
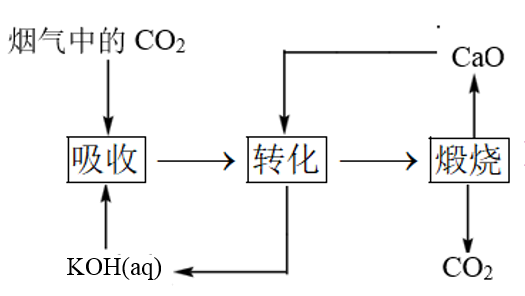
| A.A | B.B | C.C | D.D |
12.一种捕集烟气中CO2的过程如图所示。室温下以0.1mol∙L-1KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+c(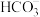 )+c(
)+c(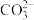 )。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是
)。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是
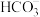 )+c(
)+c(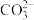 )。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是
)。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是 
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c(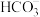 ) ) |
B.KOH完全转化为K2CO3时,溶液中:c(OH-)= c(H+)+c(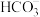 )+c(H2CO3) )+c(H2CO3) |
C.KOH溶液吸收CO2,c总=0.1mol∙L-1溶液中:c(H2CO3)>c(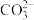 ) ) |
| D.如图所示的“吸收”“转化”过程中,溶液的温度下降 |
13.乙醇-水催化重整可获得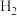 。其主要反应为
。其主要反应为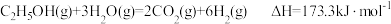 ,
,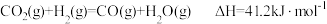 ,在
,在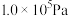 、
、 时,若仅考虑上述反应,平衡时
时,若仅考虑上述反应,平衡时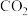 和CO的选择性及
和CO的选择性及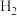 的产率随温度的变化如图所示。
的产率随温度的变化如图所示。

CO的选择性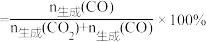 ,下列说法正确的是
,下列说法正确的是
 。其主要反应为
。其主要反应为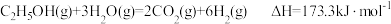 ,
,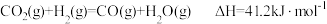 ,在
,在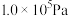 、
、 时,若仅考虑上述反应,平衡时
时,若仅考虑上述反应,平衡时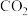 和CO的选择性及
和CO的选择性及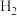 的产率随温度的变化如图所示。
的产率随温度的变化如图所示。
CO的选择性
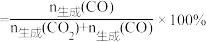 ,下列说法正确的是
,下列说法正确的是A.图中曲线①表示平衡时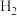 产率随温度的变化 产率随温度的变化 |
| B.升高温度,平衡时CO的选择性增大 |
C.一定温度下,增大 可提高乙醇平衡转化率 可提高乙醇平衡转化率 |
D.一定温度下,加入 或选用高效催化剂,均能提高平衡时 或选用高效催化剂,均能提高平衡时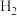 产率 产率 |
14.硫铁化合物(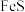 、
、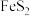 等)应用广泛。
等)应用广泛。
(1)纳米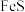 可去除水中微量六价铬
可去除水中微量六价铬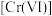 。在
。在 的水溶液中,纳米
的水溶液中,纳米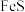 颗粒表面带正电荷,
颗粒表面带正电荷,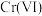 主要以
主要以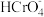 、
、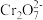 、
、 等形式存在,纳米
等形式存在,纳米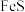 去除水中
去除水中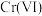 主要经过“吸附→反应→沉淀”的过程。
主要经过“吸附→反应→沉淀”的过程。
已知: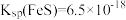 ,
,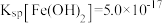 ;
; 电离常数分别为
电离常数分别为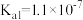 、
、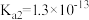 。
。
①在弱碱性溶液中,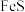 与
与 反应生成
反应生成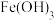 、
、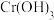 和单质S,其离子方程式为
和单质S,其离子方程式为_______ 。
②在弱酸性溶液中,反应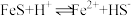 的平衡常数K的数值为
的平衡常数K的数值为_______ 。
③在 溶液中,pH越大,
溶液中,pH越大,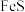 去除水中
去除水中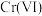 的速率越慢,原因是
的速率越慢,原因是_______ 。
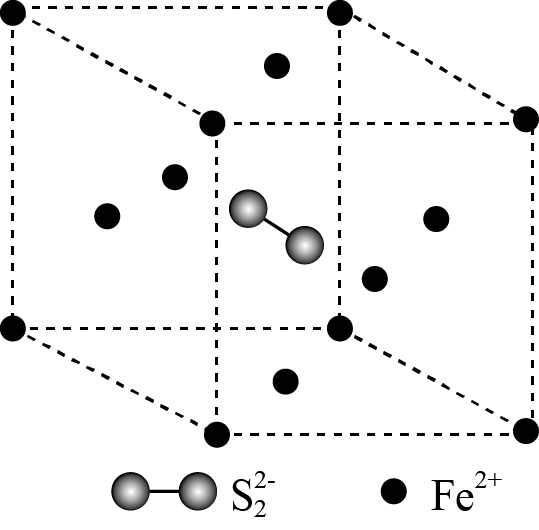
(2)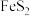 具有良好半导体性能。
具有良好半导体性能。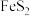 的一种晶体与
的一种晶体与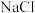 晶体的结构相似,该
晶体的结构相似,该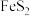 晶体的一个晶胞中
晶体的一个晶胞中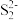 的数目为
的数目为_______ ,在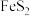 晶体中,每个S原子与三个
晶体中,每个S原子与三个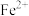 紧邻,且
紧邻,且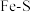 间距相等,如图给出了
间距相等,如图给出了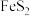 晶胞中的
晶胞中的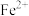 和位于晶胞体心的
和位于晶胞体心的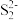 (
(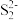 中的
中的 键位于晶胞体对角线上,晶胞中的其他
键位于晶胞体对角线上,晶胞中的其他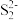 已省略)。如图中用“-”将其中一个S原子与紧邻的
已省略)。如图中用“-”将其中一个S原子与紧邻的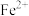 连接起来
连接起来_______ 。
(3)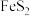 、
、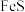 在空气中易被氧化,将
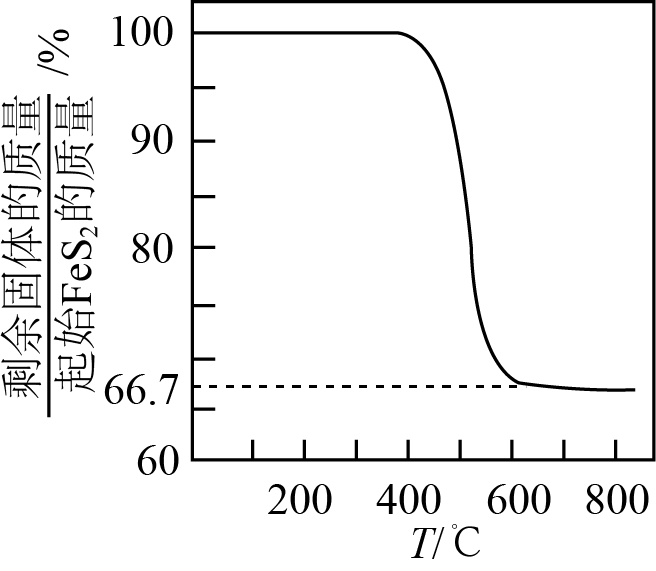
在空气中易被氧化,将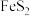 在空气中氧化,测得氧化过程中剩余固体的质量与起始
在空气中氧化,测得氧化过程中剩余固体的质量与起始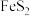 的质量的比值随温度变化的曲线如图所示。
的质量的比值随温度变化的曲线如图所示。 时,
时,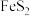 氧化成含有两种元素的固体产物为
氧化成含有两种元素的固体产物为_______ (填化学式,写出计算过程)。
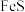 、
、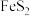 等)应用广泛。
等)应用广泛。(1)纳米
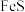 可去除水中微量六价铬
可去除水中微量六价铬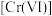 。在
。在 的水溶液中,纳米
的水溶液中,纳米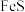 颗粒表面带正电荷,
颗粒表面带正电荷,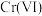 主要以
主要以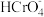 、
、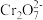 、
、 等形式存在,纳米
等形式存在,纳米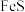 去除水中
去除水中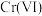 主要经过“吸附→反应→沉淀”的过程。
主要经过“吸附→反应→沉淀”的过程。已知:
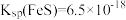 ,
,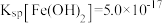 ;
; 电离常数分别为
电离常数分别为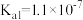 、
、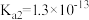 。
。①在弱碱性溶液中,
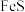 与
与 反应生成
反应生成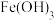 、
、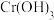 和单质S,其离子方程式为
和单质S,其离子方程式为②在弱酸性溶液中,反应
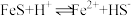 的平衡常数K的数值为
的平衡常数K的数值为③在
 溶液中,pH越大,
溶液中,pH越大,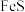 去除水中
去除水中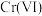 的速率越慢,原因是
的速率越慢,原因是(2)
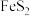 具有良好半导体性能。
具有良好半导体性能。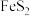 的一种晶体与
的一种晶体与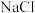 晶体的结构相似,该
晶体的结构相似,该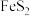 晶体的一个晶胞中
晶体的一个晶胞中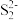 的数目为
的数目为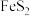 晶体中,每个S原子与三个
晶体中,每个S原子与三个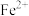 紧邻,且
紧邻,且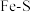 间距相等,如图给出了
间距相等,如图给出了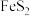 晶胞中的
晶胞中的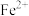 和位于晶胞体心的
和位于晶胞体心的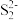 (
(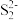 中的
中的 键位于晶胞体对角线上,晶胞中的其他
键位于晶胞体对角线上,晶胞中的其他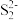 已省略)。如图中用“-”将其中一个S原子与紧邻的
已省略)。如图中用“-”将其中一个S原子与紧邻的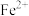 连接起来
连接起来
(3)
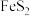 、
、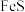 在空气中易被氧化,将
在空气中易被氧化,将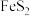 在空气中氧化,测得氧化过程中剩余固体的质量与起始
在空气中氧化,测得氧化过程中剩余固体的质量与起始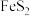 的质量的比值随温度变化的曲线如图所示。
的质量的比值随温度变化的曲线如图所示。 时,
时,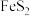 氧化成含有两种元素的固体产物为
氧化成含有两种元素的固体产物为
15.化合物G可用于药用多肽的结构修饰,其人工合成路线如下:

(1)A分子中碳原子的杂化轨道类型为_______ 。
(2)B→C的反应类型为_______ 。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______ 。
①分子中含有4种不同化学环境的氢原子;②碱性条件水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
(4)F的分子式为 ,其结构简式为
,其结构简式为_______ 。
(5)已知: (R和R'表示烃基或氢,R''表示烃基);
(R和R'表示烃基或氢,R''表示烃基);

写出以 和
和 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)_______ 。

(1)A分子中碳原子的杂化轨道类型为
(2)B→C的反应类型为
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①分子中含有4种不同化学环境的氢原子;②碱性条件水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
(4)F的分子式为
 ,其结构简式为
,其结构简式为(5)已知:
 (R和R'表示烃基或氢,R''表示烃基);
(R和R'表示烃基或氢,R''表示烃基);
写出以
 和
和 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)16.实验室以二氧化铈(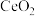 )废渣为原料制备
)废渣为原料制备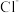 含量少的
含量少的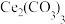 ,其部分实验过程如下:
,其部分实验过程如下:

(1)“酸浸”时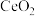 与
与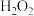 反应生成
反应生成 并放出
并放出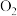 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(2)pH约为7的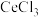 溶液与
溶液与 溶液反应可生成
溶液反应可生成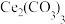 沉淀,该沉淀中
沉淀,该沉淀中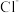 含量与加料方式有关。得到含
含量与加料方式有关。得到含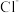 量较少的
量较少的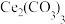 的加料方式为
的加料方式为_______ (填序号)。
A.将 溶液滴加到
溶液滴加到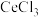 溶液中 B.将
溶液中 B.将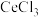 溶液滴加到
溶液滴加到 溶液中
溶液中
(3)通过中和、萃取、反萃取、沉淀等过程,可制备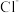 含量少的
含量少的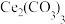 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
 (水层)+3HA(有机层)
(水层)+3HA(有机层)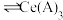 (有机层)+
(有机层)+ (水层)
(水层)
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是_______ 。
②反萃取的目的是将有机层 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有_______ (填两项)。
③与“反萃取”得到的水溶液比较,过滤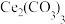 溶液的滤液中,物质的量减小的离子有
溶液的滤液中,物质的量减小的离子有_______ (填化学式)。
(4)实验中需要测定溶液中 的含量。已知水溶液中
的含量。已知水溶液中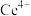 可用准确浓度的
可用准确浓度的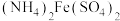 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取
。请补充完整实验方案:①准确量取 溶液[
溶液[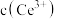 约为
约为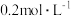 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到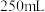 容量瓶中后定容;②按规定操作分别将
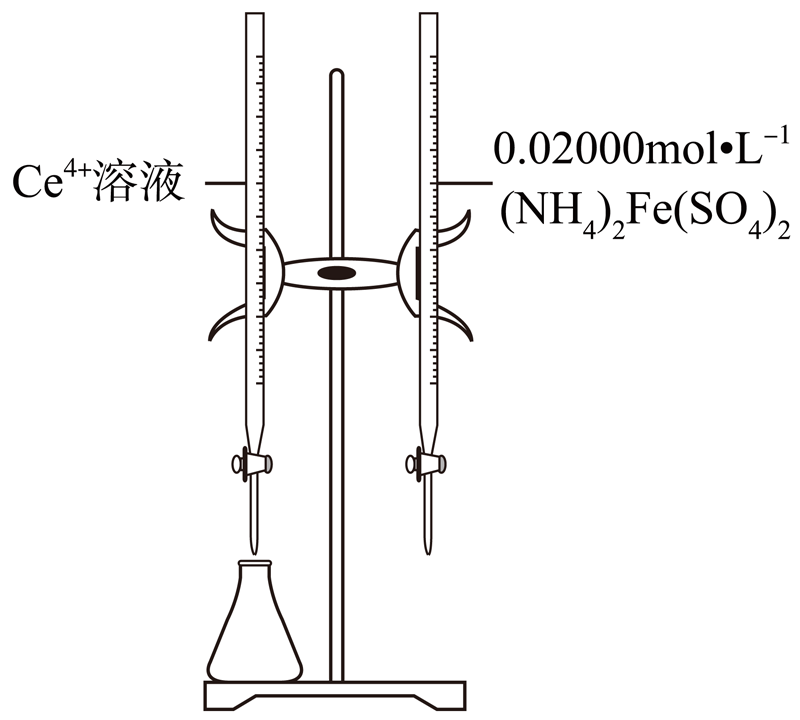
容量瓶中后定容;②按规定操作分别将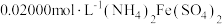 和待测
和待测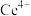 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③_______ 。
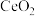 )废渣为原料制备
)废渣为原料制备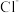 含量少的
含量少的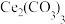 ,其部分实验过程如下:
,其部分实验过程如下:
(1)“酸浸”时
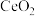 与
与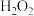 反应生成
反应生成 并放出
并放出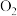 ,该反应的离子方程式为
,该反应的离子方程式为(2)pH约为7的
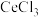 溶液与
溶液与 溶液反应可生成
溶液反应可生成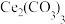 沉淀,该沉淀中
沉淀,该沉淀中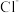 含量与加料方式有关。得到含
含量与加料方式有关。得到含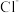 量较少的
量较少的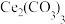 的加料方式为
的加料方式为A.将
 溶液滴加到
溶液滴加到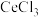 溶液中 B.将
溶液中 B.将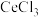 溶液滴加到
溶液滴加到 溶液中
溶液中(3)通过中和、萃取、反萃取、沉淀等过程,可制备
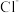 含量少的
含量少的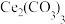 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为 (水层)+3HA(有机层)
(水层)+3HA(有机层)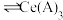 (有机层)+
(有机层)+ (水层)
(水层)①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是
②反萃取的目的是将有机层
 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有③与“反萃取”得到的水溶液比较,过滤
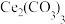 溶液的滤液中,物质的量减小的离子有
溶液的滤液中,物质的量减小的离子有(4)实验中需要测定溶液中
 的含量。已知水溶液中
的含量。已知水溶液中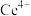 可用准确浓度的
可用准确浓度的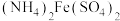 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取
。请补充完整实验方案:①准确量取 溶液[
溶液[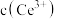 约为
约为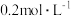 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到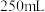 容量瓶中后定容;②按规定操作分别将
容量瓶中后定容;②按规定操作分别将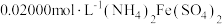 和待测
和待测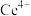 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③
17.氢气是一种清洁能源,绿色环保制氢技术研究具有重要意义。
(1)“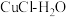 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。

①电解在质子交换膜电解池中进行。阳极区为酸性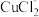 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中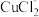 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为_______ (用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有_______ (填元素符号)。
(2)“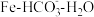 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收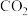 制得的
制得的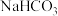 溶液反应,生成
溶液反应,生成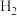 、
、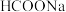 和
和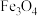 ;
;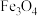 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。
①实验中发现,在 时,密闭容器中
时,密闭容器中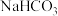 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有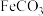 生成并放出
生成并放出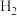 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
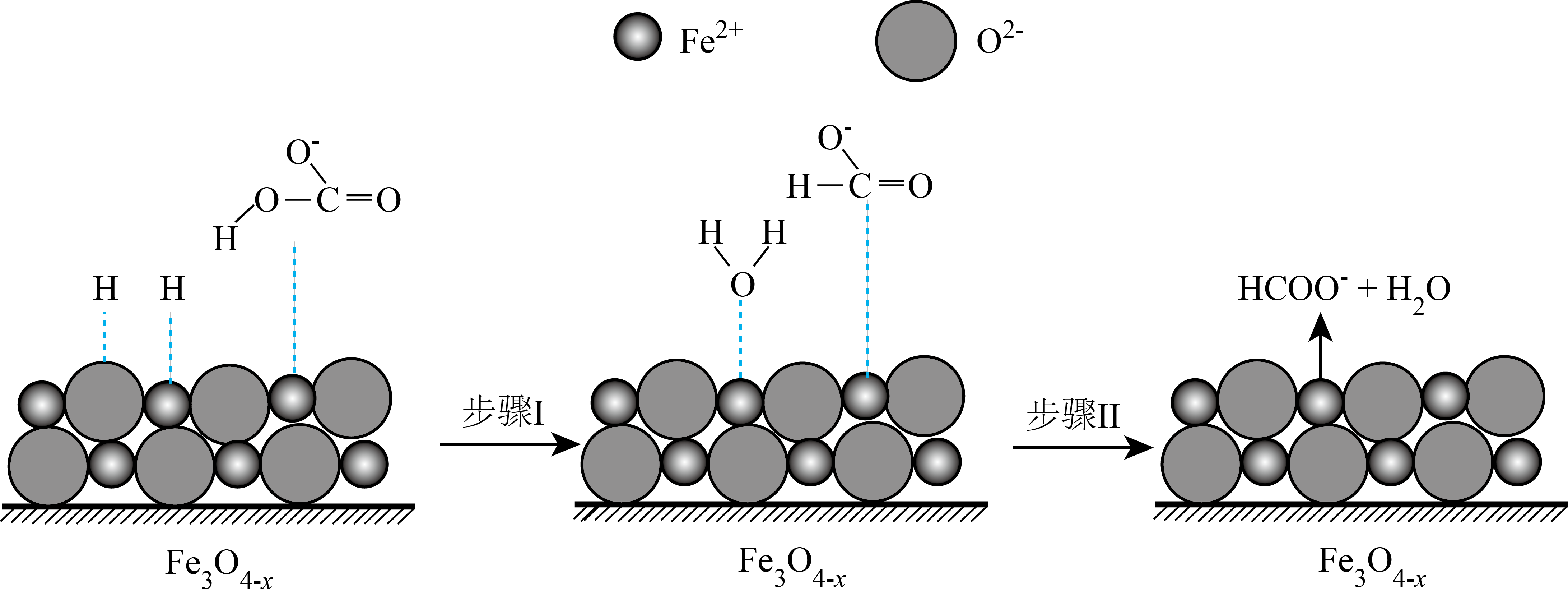
②随着反应进行,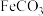 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是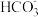 转化为
转化为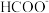 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为_______ 。
③在其他条件相同时,测得Fe的转化率、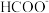 的产率随
的产率随 变化如题图所示。
变化如题图所示。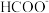 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是_______ 。
(3)从物质转化与资源综合利用角度分析,“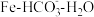 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是_______ 。
(1)“
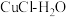 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
①电解在质子交换膜电解池中进行。阳极区为酸性
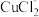 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中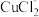 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有
(2)“
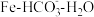 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收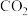 制得的
制得的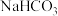 溶液反应,生成
溶液反应,生成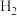 、
、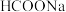 和
和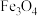 ;
;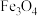 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。①实验中发现,在
 时,密闭容器中
时,密闭容器中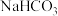 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有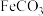 生成并放出
生成并放出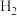 ,该反应的离子方程式为
,该反应的离子方程式为②随着反应进行,
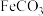 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是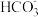 转化为
转化为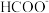 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
③在其他条件相同时,测得Fe的转化率、
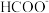 的产率随
的产率随 变化如题图所示。
变化如题图所示。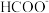 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是
(3)从物质转化与资源综合利用角度分析,“
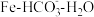 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
