全一卷
1.北京冬奥会备受世界瞩目。下列说法错误的是
| A.冰壶主材料花岗岩属于无机非金属材料 |
| B.火炬“飞扬”使用的碳纤维属于有机高分子材料 |
| C.冬奥会“同心”金属奖牌属于合金材料 |
| D.短道速滑服使用的超高分子量聚乙烯属于有机高分子材料 |
2.下列符号表征或说法正确的是
A. 电离: 电离: | B. 位于元素周期表p区 位于元素周期表p区 |
C. 空间结构:平面三角形 空间结构:平面三角形 | D. 电子式: 电子式: |
3.设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A. 中含有的中子数为 中含有的中子数为 |
B. 分子中含有的 分子中含有的 键数目为 键数目为 |
C.标准状况下, 气体中 气体中 数目为 数目为 |
D. 的 的 溶液中 溶液中 数目为0.01NA 数目为0.01NA |
4.下列关于苯乙炔(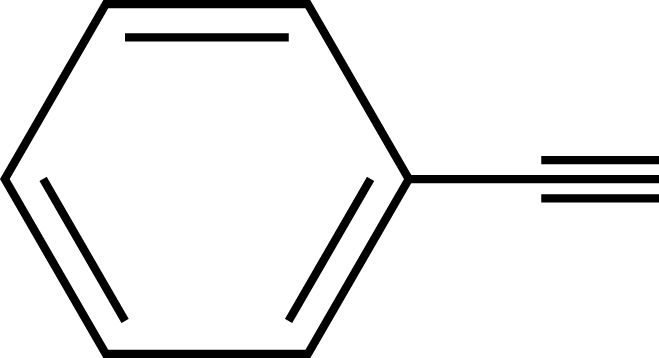 )的说法正确的是
)的说法正确的是
 )的说法正确的是
)的说法正确的是A.不能使酸性 溶液褪色 溶液褪色 | B.分子中最多有5个原子共直线 |
| C.能发生加成反应和取代反应 | D.可溶于水 |
5.短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是
| A.X能与多种元素形成共价键 | B.简单氢化物沸点: |
C.第一电离能: | D.电负性: |
6.镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入 ,振荡,静置,液体分层。下列说法正确的是
,振荡,静置,液体分层。下列说法正确的是
 ,振荡,静置,液体分层。下列说法正确的是
,振荡,静置,液体分层。下列说法正确的是A.褪色原因为 被 被 还原 还原 | B.液体分层后,上层呈紫红色 |
| C.镀锌铁钉比镀锡铁钉更易生锈 | D.溶液恢复棕色的原因为 被氧化 被氧化 |
7.理论化学模拟得到一种 离子,结构如图。下列关于该离子的说法错误的是
离子,结构如图。下列关于该离子的说法错误的是

 离子,结构如图。下列关于该离子的说法错误的是
离子,结构如图。下列关于该离子的说法错误的是
| A.所有原子均满足8电子结构 | B.N原子的杂化方式有2种 |
| C.空间结构为四面体形 | D.常温下不稳定 |
8.下列类比或推理合理的是
| 已知 | 方法 | 结论 | |
| A | 沸点: | 类比 | 沸点: |
| B | 酸性: | 类比 | 酸性: |
| C | 金属性: | 推理 | 氧化性: |
| D |  : : | 推理 | 溶解度: |
| A.A | B.B | C.C | D.D |
9.如图,c管为上端封口的量气管,为测定乙酸溶液浓度,量取 待测样品加入b容器中,接通电源,进行实验。下列说法正确的是
待测样品加入b容器中,接通电源,进行实验。下列说法正确的是

 待测样品加入b容器中,接通电源,进行实验。下列说法正确的是
待测样品加入b容器中,接通电源,进行实验。下列说法正确的是
A.左侧电极反应: |
| B.实验结束时,b中溶液红色恰好褪去 |
C.若c中收集气体 ,则样品中乙酸浓度为 ,则样品中乙酸浓度为 |
| D.把盐桥换为U形铜导线,不影响测定结果 |
10.利用有机分子模拟生物体内“醛缩酶”催化Diels-Alder反应取得重要进展,荣获2021年诺贝尔化学奖。某Diels-Alder反应催化机理如下,下列说法错误的是


| A.总反应为加成反应 | B.Ⅰ和Ⅴ互为同系物 |
| C.Ⅵ是反应的催化剂 | D.化合物X为 |
11. 、
、 均可自耦电离:
均可自耦电离: 、
、 。下列反应与
。下列反应与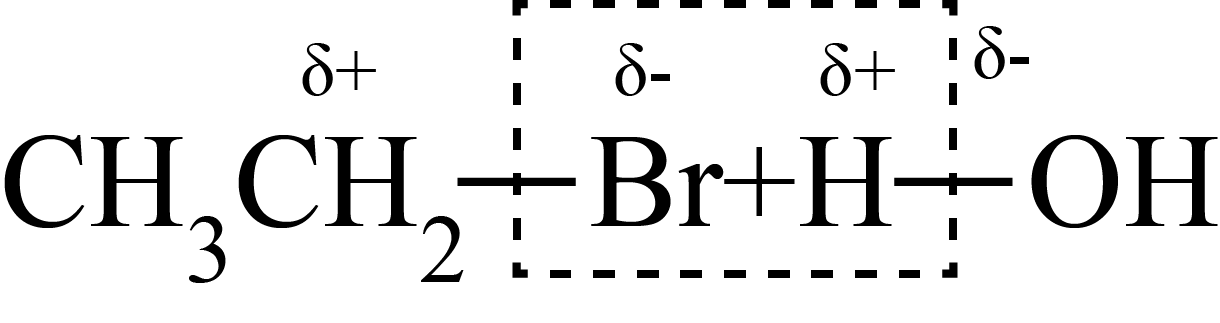
 CH3CH2OH+HBr原理不同的是
CH3CH2OH+HBr原理不同的是
 、
、 均可自耦电离:
均可自耦电离: 、
、 。下列反应与
。下列反应与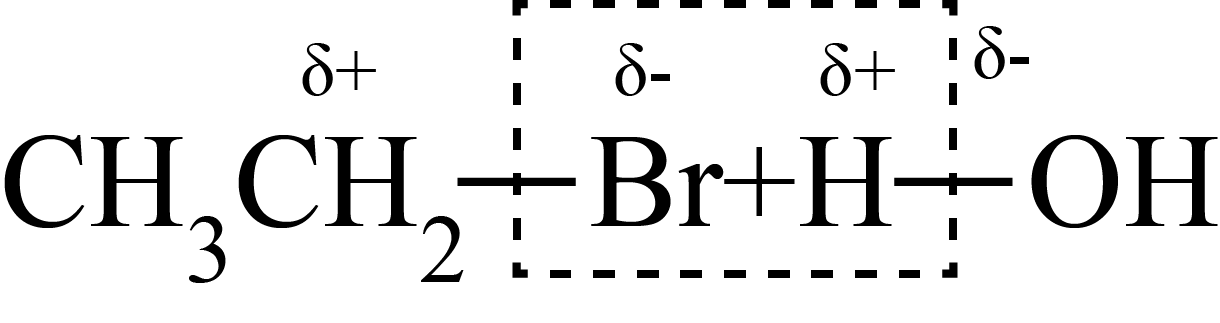
 CH3CH2OH+HBr原理不同的是
CH3CH2OH+HBr原理不同的是A. | B. |
C. | D. |
12.某温度下,在 恒容密闭容器中
恒容密闭容器中 发生反应
发生反应 ,有关数据如下:
,有关数据如下:
下列说法错误的是
 恒容密闭容器中
恒容密闭容器中 发生反应
发生反应 ,有关数据如下:
,有关数据如下:时间段/ | 产物Z的平均生成速率/ |
| 0~2 | 0.20 |
| 0~4 | 0.15 |
| 0~6 | 0.10 |
A. 时,Z的浓度大于 时,Z的浓度大于 |
B. 时,加入 时,加入 ,此时 ,此时 |
C. 时,Y的体积分数约为33.3% 时,Y的体积分数约为33.3% |
D. 时,X的物质的量为 时,X的物质的量为 |
13.下列实验能达到目的的是
| 实验目的 | 实验方法或操作 | |
| A | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
| B | 探究浓度对化学反应速率的影响 | 量取同体积不同浓度的 溶液,分别加入等体积等浓度的 溶液,分别加入等体积等浓度的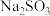 溶液,对比现象 溶液,对比现象 |
| C | 判断反应后 是否沉淀完全 是否沉淀完全 | 将 溶液与 溶液与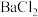 溶液混合,反应后静置,向上层清液中再加1滴 溶液混合,反应后静置,向上层清液中再加1滴 溶液 溶液 |
| D | 检验淀粉是否发生了水解 | 向淀粉水解液中加入碘水 |
| A.A | B.B | C.C | D.D |
14.某储能电池原理如图。下列说法正确的是


A.放电时负极反应: |
B.放电时 透过多孔活性炭电极向 透过多孔活性炭电极向 中迁移 中迁移 |
C.放电时每转移 电子,理论上 电子,理论上 吸收 吸收 |
D.充电过程中, 溶液浓度增大 溶液浓度增大 |
15.甘氨酸 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、 和
和 的分布分数【如
的分布分数【如 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是

 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、 和
和 的分布分数【如
的分布分数【如 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是
| A.甘氨酸具有两性 |
B.曲线c代表 |
C. 的平衡常数 的平衡常数 |
D. |
16.某工厂采用辉铋矿(主要成分为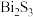 ,含有
,含有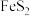 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为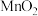 )联合焙烧法制各
)联合焙烧法制各 和
和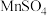 ,工艺流程如下:
,工艺流程如下:

已知:①焙烧时过量的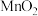 分解为
分解为 ,
,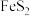 转变为
转变为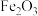 ;
;
②金属活动性: ;
;
③相关金属离子形成氢氧化物的 范围如下:
范围如下:
回答下列问题:
(1)为提高焙烧效率,可采取的措施为_______ 。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2)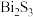 在空气中单独焙烧生成
在空气中单独焙烧生成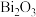 ,反应的化学方程式为
,反应的化学方程式为_______ 。
(3)“酸浸”中过量浓盐酸的作用为:①充分浸出 和
和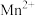 ;②
;②_______ 。
(4)滤渣的主要成分为_______ (填化学式)。
(5)生成气体A的离子方程式为_______ 。
(6)加入金属Bi的目的是_______ 。
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量 产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为
产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为_______ 。
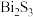 ,含有
,含有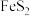 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为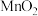 )联合焙烧法制各
)联合焙烧法制各 和
和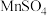 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的
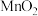 分解为
分解为 ,
,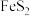 转变为
转变为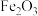 ;
;②金属活动性:
 ;
;③相关金属离子形成氢氧化物的
 范围如下:
范围如下:开始沉淀 | 完全沉淀 | |
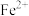 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
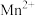 | 8.1 | 10.1 |
回答下列问题:
(1)为提高焙烧效率,可采取的措施为
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2)
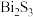 在空气中单独焙烧生成
在空气中单独焙烧生成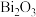 ,反应的化学方程式为
,反应的化学方程式为(3)“酸浸”中过量浓盐酸的作用为:①充分浸出
 和
和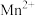 ;②
;②(4)滤渣的主要成分为
(5)生成气体A的离子方程式为
(6)加入金属Bi的目的是
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量
 产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为
产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为17.工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为: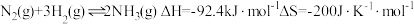 。回答下列问题:
。回答下列问题:
(1)合成氨反应在常温下_______ (填“能”或“不能”)自发。
(2)_______ 温(填“高”或“低”,下同)有利于提高反应速率,_______ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用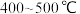 。
。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案一:双温-双控-双催化剂。使用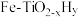 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为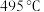 时,
时,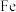 的温度为
的温度为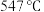 ,而
,而 的温度为
的温度为 )。
)。
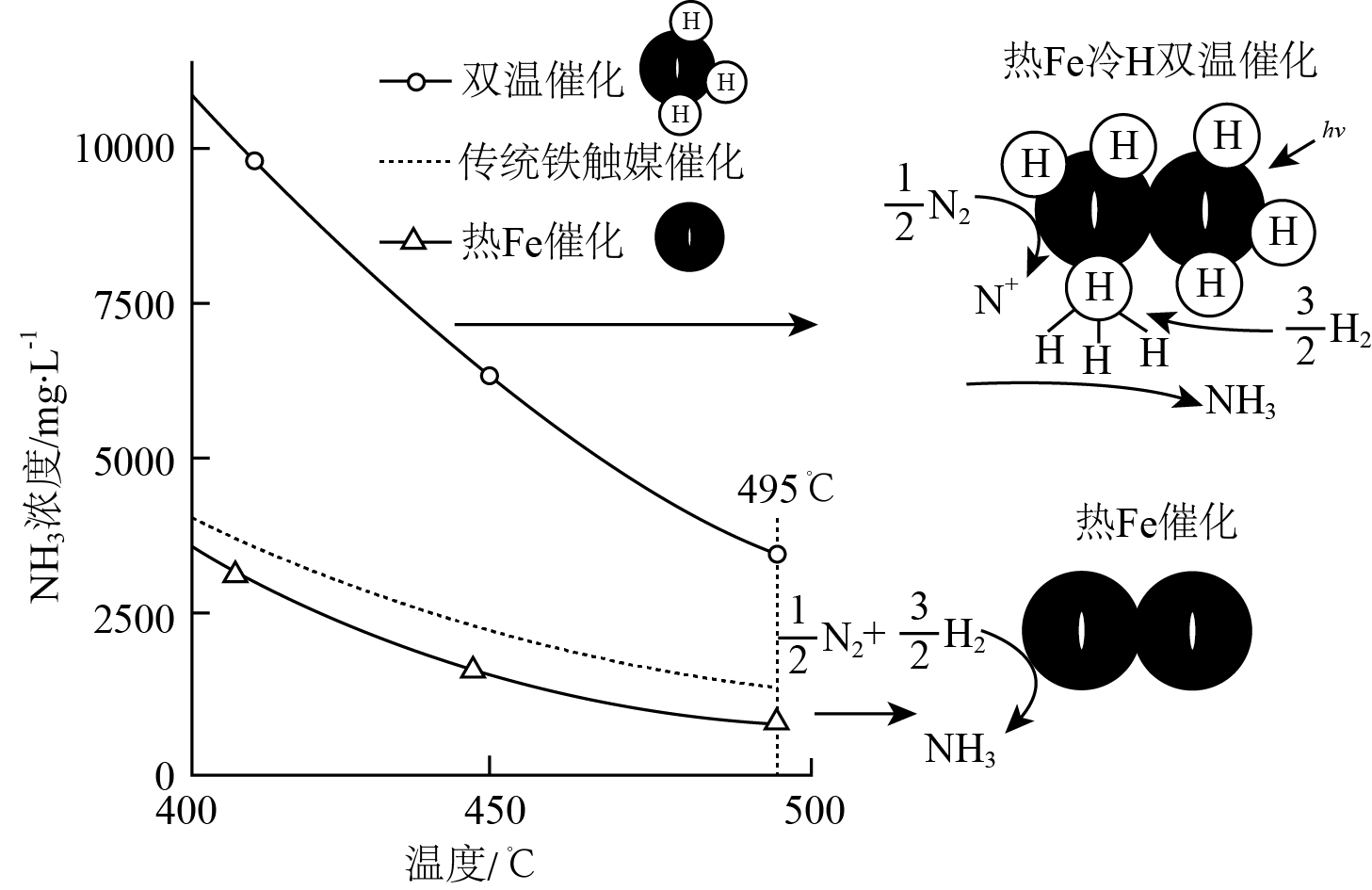
下列说法正确的是_______ 。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b. 在“热Fe”表面断裂,有利于提高合成氨反应速率
在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(4)方案二: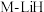 复合催化剂。
复合催化剂。
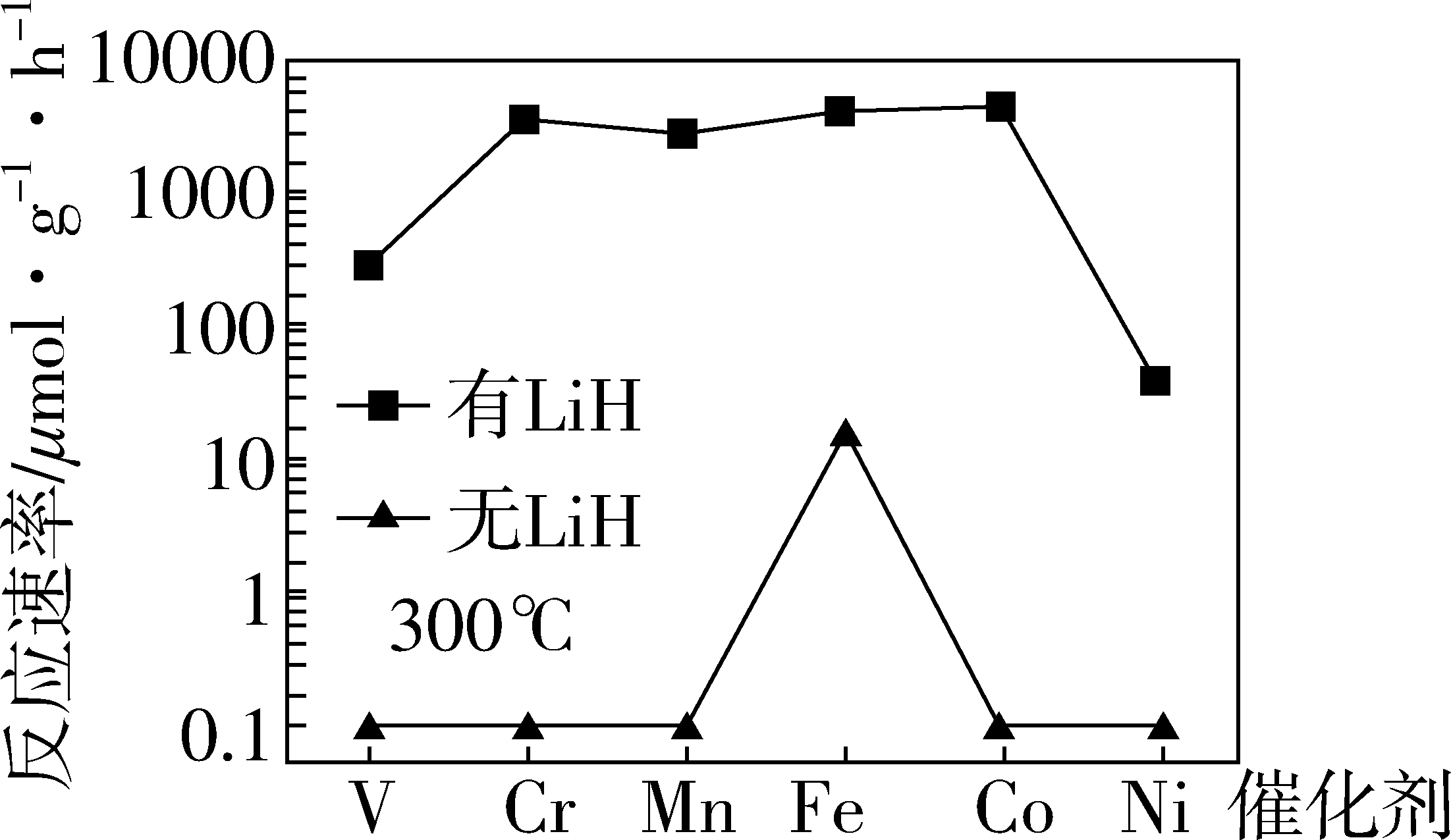
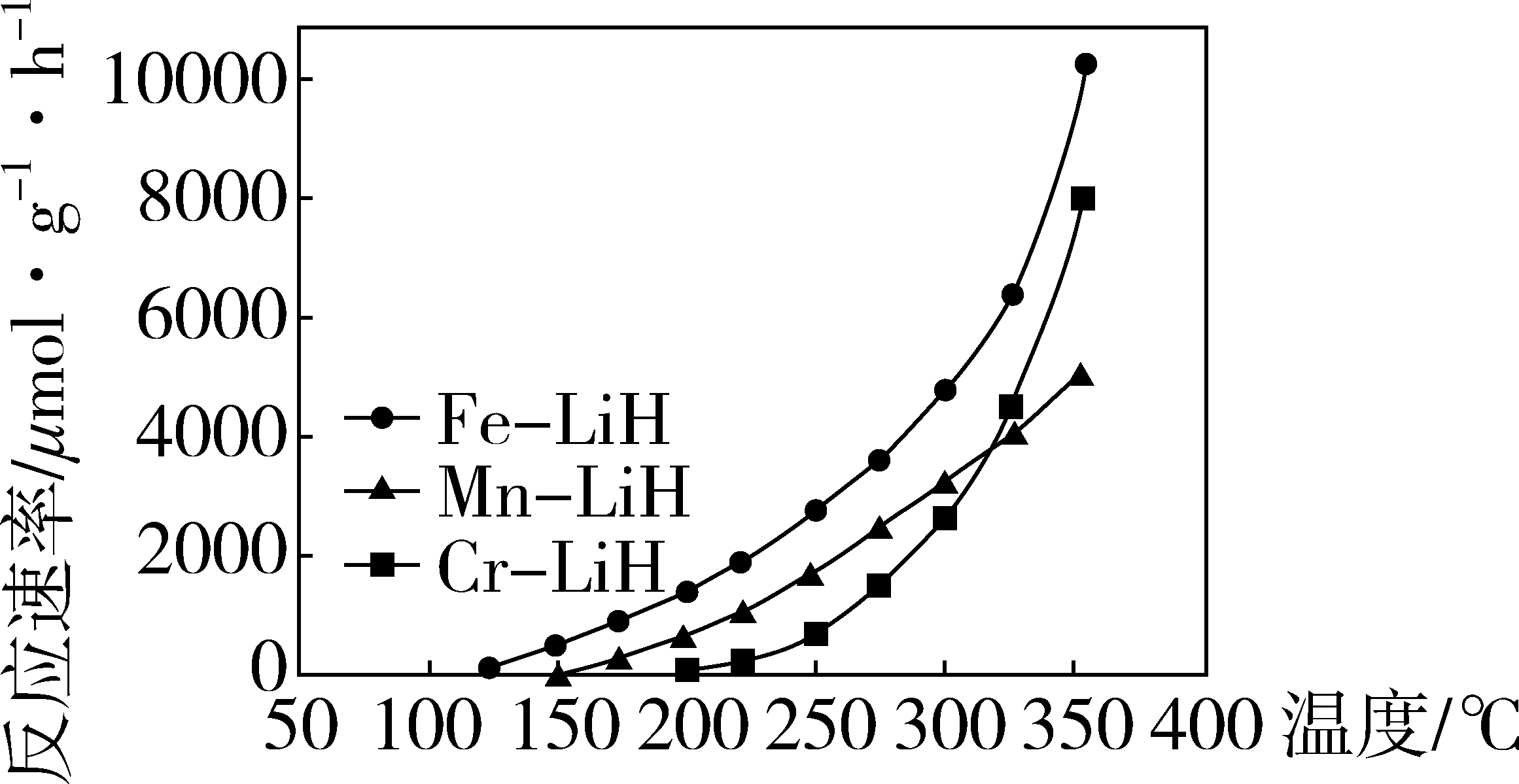
下列说法正确的是_______ 。
a. 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(5)某合成氨速率方程为: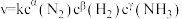 ,根据表中数据,
,根据表中数据,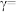
_______ ;
在合成氨过程中,需要不断分离出氨的原因为_______ 。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
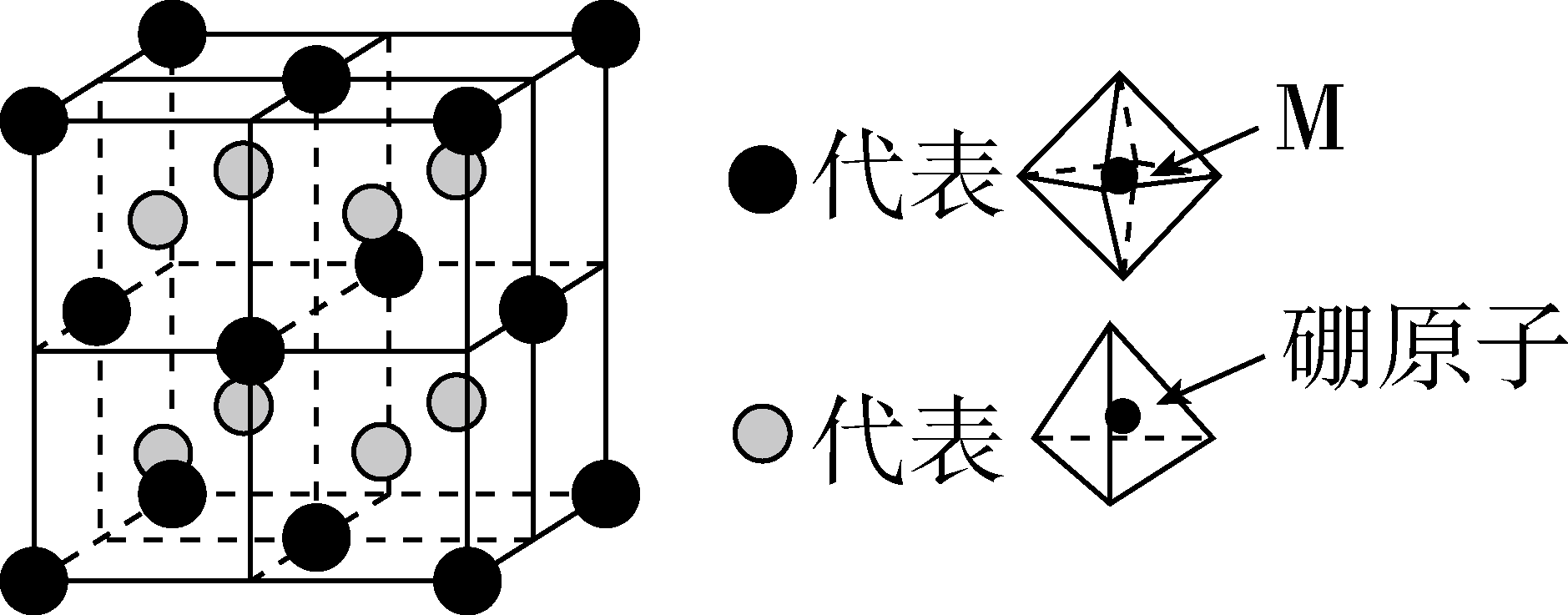
(6)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为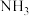 配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为
配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为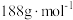 ,则M元素为
,则M元素为_______ (填元素符号);在该化合物中,M离子的价电子排布式为_______ 。
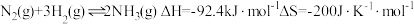 。回答下列问题:
。回答下列问题:(1)合成氨反应在常温下
(2)
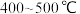 。
。针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案一:双温-双控-双催化剂。使用
 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为 时,
时,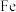 的温度为
的温度为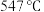 ,而
,而 的温度为
的温度为 )。
)。
下列说法正确的是
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.
 在“热Fe”表面断裂,有利于提高合成氨反应速率
在“热Fe”表面断裂,有利于提高合成氨反应速率c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(4)方案二:
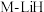 复合催化剂。
复合催化剂。

下列说法正确的是
a.
 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(5)某合成氨速率方程为:
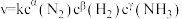 ,根据表中数据,
,根据表中数据,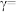
| 实验 |  |  |  |  |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
在合成氨过程中,需要不断分离出氨的原因为
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(6)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为
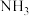 配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为
配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为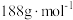 ,则M元素为
,则M元素为
18. 作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下:

已知: 、
、 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:
(1)A中反应的离子方程式为___________ 。
(2)装置B应为___________ (填序号)。

(3)检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞___________ ,控温 。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞
。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞___________ ,继续反应一段时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。
(4)装置F的作用为___________ 。
(5)反应过程中,控温 的原因为
的原因为___________ 。
(6)氢醌法制备 总反应的化学方程式为
总反应的化学方程式为___________ 。
(7)取 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为___________ 。
 作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下:
已知:
 、
、 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:(1)A中反应的离子方程式为
(2)装置B应为

(3)检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞
 。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞
。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞(4)装置F的作用为
(5)反应过程中,控温
 的原因为
的原因为(6)氢醌法制备
 总反应的化学方程式为
总反应的化学方程式为(7)取
 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为19.某药物成分H具有抗炎、抗病毒、抗氧化等生物活性,其合成路线如下:
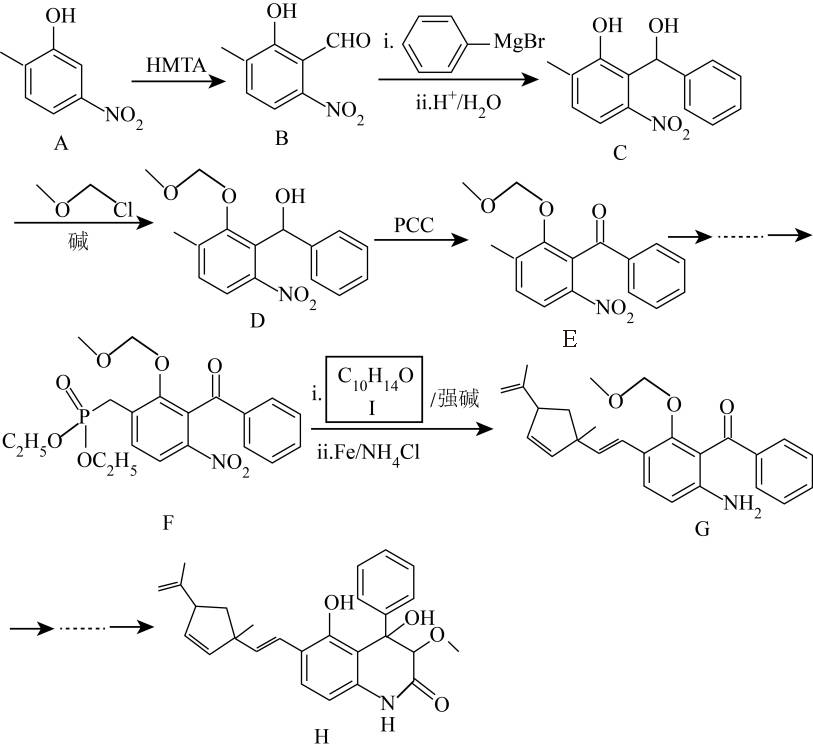
已知: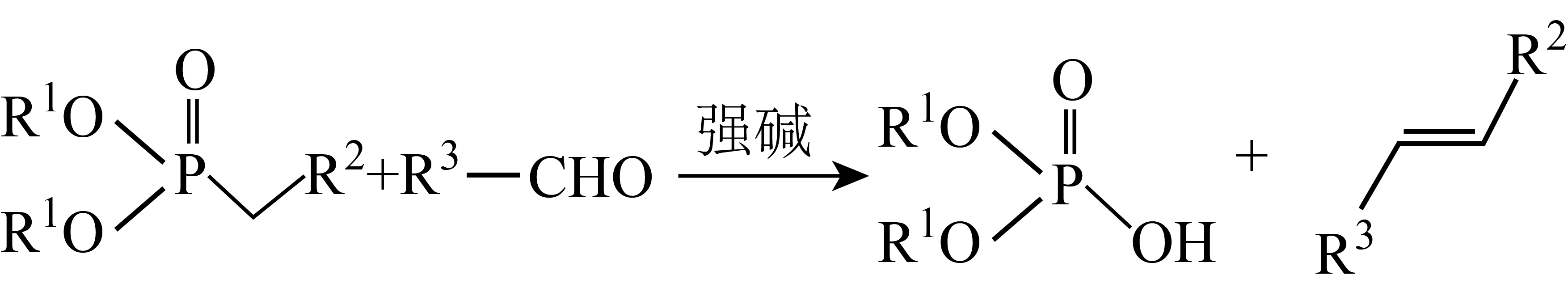
回答下列问题:
(1)A的分子式为___________ 。
(2)在 溶液中,苯酚与
溶液中,苯酚与 反应的化学方程式为
反应的化学方程式为___________ 。
(3) 中对应碳原子杂化方式由
中对应碳原子杂化方式由___________ 变为___________ , 的作用为
的作用为___________ 。
(4) 中步骤ⅱ实现了由
中步骤ⅱ实现了由___________ 到___________ 的转化(填官能团名称)。
(5)I的结构简式为___________ 。
(6)化合物I的同分异构体满足以下条件的有___________ 种(不考虑立体异构);
i.含苯环且苯环上只有一个取代基
ii.红外光谱无醚键吸收峰
其中,苯环侧链上有3种不同化学环境的氢原子,且个数比为6∶2∶1的结构简式为___________ (任写一种)。

已知:

回答下列问题:
(1)A的分子式为
(2)在
 溶液中,苯酚与
溶液中,苯酚与 反应的化学方程式为
反应的化学方程式为(3)
 中对应碳原子杂化方式由
中对应碳原子杂化方式由 的作用为
的作用为(4)
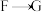 中步骤ⅱ实现了由
中步骤ⅱ实现了由(5)I的结构简式为
(6)化合物I的同分异构体满足以下条件的有
i.含苯环且苯环上只有一个取代基
ii.红外光谱无醚键吸收峰
其中,苯环侧链上有3种不同化学环境的氢原子,且个数比为6∶2∶1的结构简式为
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
