全一卷
1.化学与生活密切相关。下列叙述正确的是
| A.漂白粉与盐酸可混合使用以提高消毒效果 | B.温室气体是形成酸雨的主要物质 |
| C.棉花、麻和蚕丝均为碳水化合物 | D.干冰可用在舞台上制造“云雾” |
2.辅酶 具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶
具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶 的说法正确的是
的说法正确的是

 具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶
具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶 的说法正确的是
的说法正确的是
A.分子式为 | B.分子中含有14个甲基 |
| C.分子中的四个氧原子不在同一平面 | D.可发生加成反应,不能发生取代反应 |
3.能正确表示下列反应的离子方程式为
| A.硫化钠溶液和硝酸混合:S2-+2H+=H2S↑ |
B.明矾溶液与过量氨水混合:Al3++4NH3+2H2O=AlO +4NH +4NH |
C.硅酸钠溶液中通入二氧化碳:SiO +CO2+H2O=HSiO +CO2+H2O=HSiO +HCO +HCO |
D.将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1∶2混合:Ba2++2OH-+2H++SO =BaSO4↓+2H2O =BaSO4↓+2H2O |
4.一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以Zn(OH) 存在)。电池放电时,下列叙述错误的是
存在)。电池放电时,下列叙述错误的是

 存在)。电池放电时,下列叙述错误的是
存在)。电池放电时,下列叙述错误的是
| A.Ⅱ区的K+通过隔膜向Ⅲ区迁移 |
B.Ⅰ区的SO 通过隔膜向Ⅱ区迁移 通过隔膜向Ⅱ区迁移 |
| C. MnO2电极反应:MnO2+2e-+4H+=Mn2++2H2O |
D.电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH) +Mn2++2H2O +Mn2++2H2O |
5.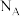 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
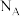 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.25℃, 下, 下, 氢气中质子的数目为 氢气中质子的数目为 |
B. 溶液中, 溶液中, 的数目为 的数目为 |
C. 苯甲酸完全燃烧,生成 苯甲酸完全燃烧,生成 的数目为 的数目为 |
D.电解熔融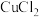 ,阴极增重 ,阴极增重 ,外电路中通过电子的数目为 ,外电路中通过电子的数目为 |
6.Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍。下列说法正确的是
A.非金属性: | B.单质的熔点: |
C.简单氢化物的沸点: | D.最高价含氧酸的酸性: |
7.根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 比较 和 和 的水解常数 的水解常数 | 分别测浓度均为 的 的 和 和 溶液的 溶液的 ,后者大于前者 ,后者大于前者 |  |
| B | 检验铁锈中是否含有二价铁 | 将铁锈溶于浓盐酸,滴入 溶液,紫色褪去 溶液,紫色褪去 | 铁锈中含有二价铁 |
| C | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向 溶液中缓慢滴加硫酸,黄色变为橙红色 溶液中缓慢滴加硫酸,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
| D | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
| A.A | B.B | C.C | D.D |
8.硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:

本题中所涉及离子的氢氧化物溶度积常数如下表:
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______ 。
(2)为了提高锌的浸取效果,可采取的措施有_______ 、_______ 。
(3)加入物质X调溶液 ,最适宜使用的X是
,最适宜使用的X是_______ (填标号)。
A. B.
B. C.
C.
滤渣①的主要成分是_______ 、_______ 、_______ 。
(4)向 的滤液①中分批加入适量
的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有
溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为
,该步反应的离子方程式为_______ 。
(5)滤液②中加入锌粉的目的是_______ 。
(6)滤渣④与浓 反应可以释放HF并循环利用,同时得到的副产物是
反应可以释放HF并循环利用,同时得到的副产物是_______ 、_______ 。

本题中所涉及离子的氢氧化物溶度积常数如下表:
| 离子 |  |  |  |  |  |
 |  |  |  |  |  |
(1)菱锌矿焙烧生成氧化锌的化学方程式为
(2)为了提高锌的浸取效果,可采取的措施有
(3)加入物质X调溶液
 ,最适宜使用的X是
,最适宜使用的X是A.
 B.
B. C.
C.
滤渣①的主要成分是
(4)向
 的滤液①中分批加入适量
的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有
溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为
,该步反应的离子方程式为(5)滤液②中加入锌粉的目的是
(6)滤渣④与浓
 反应可以释放HF并循环利用,同时得到的副产物是
反应可以释放HF并循环利用,同时得到的副产物是9.硫化钠可广泛用于染料、医药行业。工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列问题:
(1)工业上常用芒硝( )和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为
)和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为_______ 。
(2)溶解回流装置如图所示,回流前无需加入沸石,其原因是_______ 。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3.若气雾上升过高,可采取的措施是_______ 。

(3)回流时间不宜过长,原因是_______ 。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为_______ (填标号)。
A.①②③ B.③①② C.②①③ D.①③②
(4)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是_______ 。过滤除去的杂质为_______ 。若滤纸上析出大量晶体,则可能的原因是_______ 。
(5)滤液冷却、结晶、过滤,晶体用少量_______ 洗涤,干燥,得到 。
。
(1)工业上常用芒硝(
 )和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为
)和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为(2)溶解回流装置如图所示,回流前无需加入沸石,其原因是

(3)回流时间不宜过长,原因是
A.①②③ B.③①② C.②①③ D.①③②
(4)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是
(5)滤液冷却、结晶、过滤,晶体用少量
 。
。10.金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石 转化为
转化为 ,再进一步还原得到钛。回答下列问题:
,再进一步还原得到钛。回答下列问题:
(1) 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
(ⅱ)碳氯化:
①反应 的
的 为
为_______  ,
,
_______ Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是_______ 。
③对于碳氯化反应:增大压强,平衡_______ 移动(填“向左”“向右”或“不”);温度升高,平衡转化率_______ (填“变大”“变小”或“不变”)。
(2)在 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①反应 的平衡常数
的平衡常数
_______  。
。
②图中显示,在 平衡时
平衡时 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是_______ 。
(3) 碳氯化是一个“气—固—固”反应,有利于
碳氯化是一个“气—固—固”反应,有利于 “固—固”接触的措施是
“固—固”接触的措施是_______ 。
 转化为
转化为 ,再进一步还原得到钛。回答下列问题:
,再进一步还原得到钛。回答下列问题:(1)
 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:

(ⅱ)碳氯化:

①反应
 的
的 为
为 ,
,
②碳氯化的反应趋势远大于直接氯化,其原因是
③对于碳氯化反应:增大压强,平衡
(2)在
 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应
 的平衡常数
的平衡常数
 。
。②图中显示,在
 平衡时
平衡时 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是(3)
 碳氯化是一个“气—固—固”反应,有利于
碳氯化是一个“气—固—固”反应,有利于 “固—固”接触的措施是
“固—固”接触的措施是11.2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为_______ 。
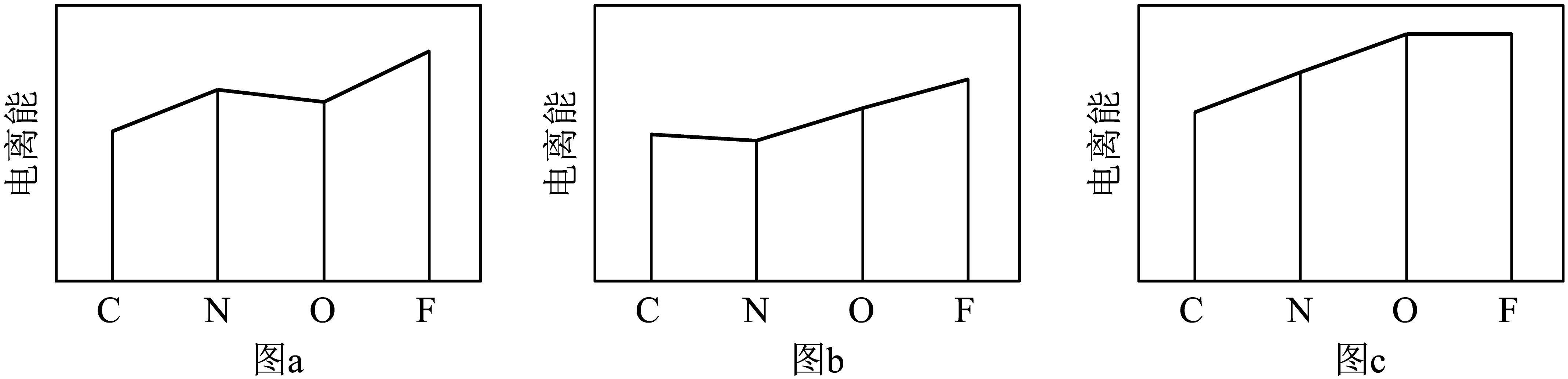
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______ (填标号),判断的根据是_______ ;第三电离能的变化图是_______ (填标号)。
(3)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构_______ 。
(4) CF2=CF2和ETFE分子中C的杂化轨道类型分别为_______ 和_______ ;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_______ 。
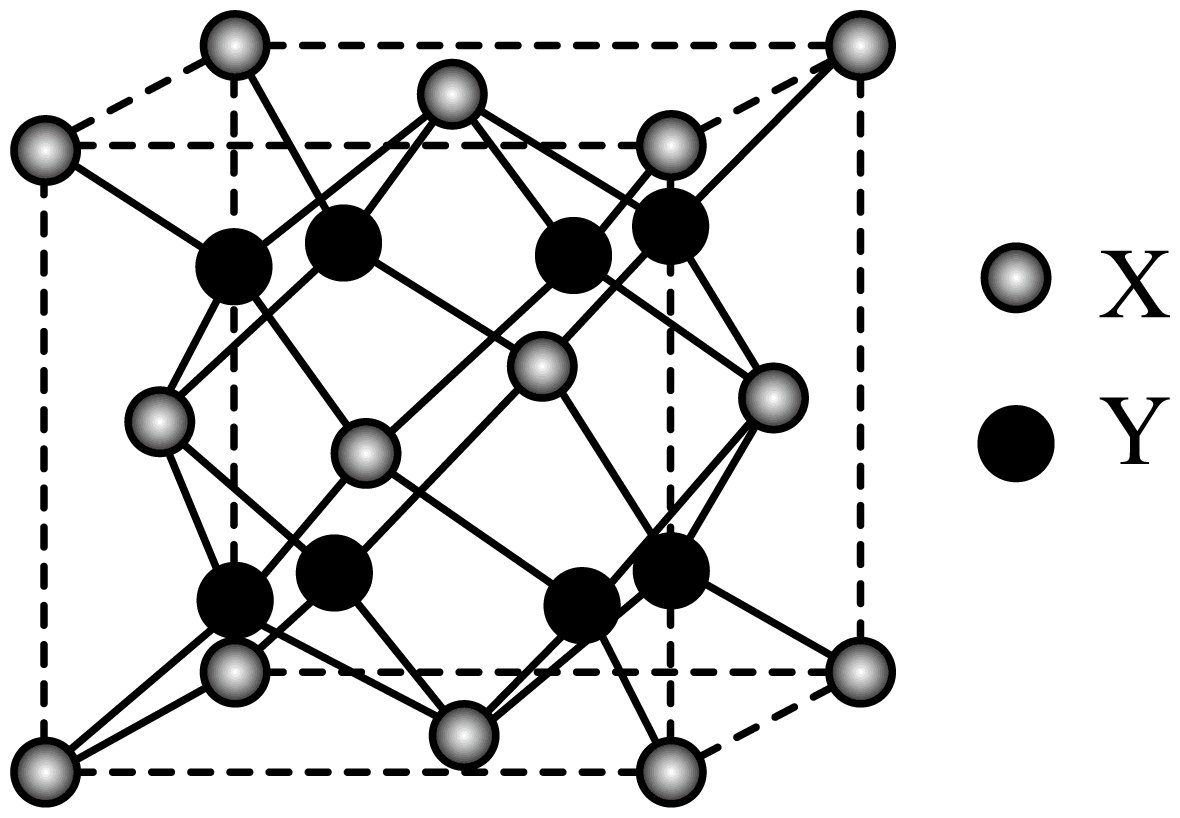
(5)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______ ;若该立方晶胞参数为a pm,正负离子的核间距最小为_______ pm。
(1)基态F原子的价电子排布图(轨道表示式)为
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(3)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构
(4) CF2=CF2和ETFE分子中C的杂化轨道类型分别为
(5)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是

12.用N-杂环卡其碱(NHC base)作为催化剂,可合成多环化合物。下面是一种多环化合物H的合成路线(无需考虑部分中间体的立体化学)。

回答下列问题:
(1)A的化学名称为_______ 。
(2)反应②涉及两步反应,已知第一步反应类型为加成反应,第二步的反应类型为_______ 。
(3)写出C与 /
/ 反应产物的结构简式
反应产物的结构简式_______ 。
(4)E的结构简式为_______ 。
(5)H中含氧官能团的名称是_______ 。
(6)化合物X是C的同分异构体,可发生银镜反应,与酸性高锰酸钾反应后可以得到对苯二甲酸,写出X的结构简式_______ 。
(7)如果要合成H的类似物H′( ),参照上述合成路线,写出相应的D′和G′的结构简式
),参照上述合成路线,写出相应的D′和G′的结构简式_______ 、_______ 。H′分子中有_______ 个手性碳(碳原子上连有4个不同的原子或基团时,该碳称为手性碳)。

回答下列问题:
(1)A的化学名称为
(2)反应②涉及两步反应,已知第一步反应类型为加成反应,第二步的反应类型为
(3)写出C与
 /
/ 反应产物的结构简式
反应产物的结构简式(4)E的结构简式为
(5)H中含氧官能团的名称是
(6)化合物X是C的同分异构体,可发生银镜反应,与酸性高锰酸钾反应后可以得到对苯二甲酸,写出X的结构简式
(7)如果要合成H的类似物H′(
 ),参照上述合成路线,写出相应的D′和G′的结构简式
),参照上述合成路线,写出相应的D′和G′的结构简式 搜索
搜索
 难度系数:0.65
难度系数:0.65  答案解析
答案解析
 有奖纠错
有奖纠错
