全一卷
1.利用如图所示装置(夹持装置略)进行实验,b中现象不能 证明a中产物生成的是


| a中反应 | b中检测试剂及现象 | |
| A | 浓 分解生成 分解生成 | 淀粉 溶液变蓝 溶液变蓝 |
| B |  与浓 与浓 生成 生成 | 品红溶液褪色 |
| C | 浓 与 与 溶液生成 溶液生成 | 酚酞溶液变红 |
| D |  与 与 乙醇溶液生成丙烯 乙醇溶液生成丙烯 | 溴水褪色 |
| A.A | B.B | C.C | D.D |
2.高分子Y是一种人工合成的多肽,其合成路线如下。

下列说法不正确 的是

下列说法
| A.F中含有2个酰胺基 | B.高分子Y水解可得到E和G |
| C.高分子X中存在氢键 | D.高分子Y的合成过程中进行了官能团保护 |
3.某 的多孔材料刚好可将
的多孔材料刚好可将 “固定”,实现了
“固定”,实现了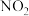 与
与 分离并制备
分离并制备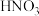 ,如图所示。
,如图所示。

己知: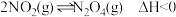
下列说法不正确 的是
 的多孔材料刚好可将
的多孔材料刚好可将 “固定”,实现了
“固定”,实现了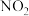 与
与 分离并制备
分离并制备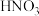 ,如图所示。
,如图所示。
己知:
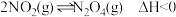
下列说法
A.气体温度升高后,不利于 的固定 的固定 |
B. 被固定后,平衡正移,有利于 被固定后,平衡正移,有利于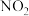 的去除 的去除 |
C.制备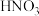 的原理为: 的原理为: |
D.每制备 ,转移电子数约为 ,转移电子数约为 |
4.利用下图装置进行铁上电镀铜的实验探究。
下列说法不正确 的是
| 装置示意图 | 序号 | 电解质溶液 | 实验现象 |
 | ① | 0.1mol/LCuSO4 +少量H2SO4 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| ② | 0.1mol/LCuSO4 +过量氨水 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 元素 元素 |
A.①中气体减少,推测是由于溶液中 减少,且 减少,且 覆盖铁电极,阻碍 覆盖铁电极,阻碍 与铁接触 与铁接触 |
B.①中检测到 ,推测可能发生反应: ,推测可能发生反应: |
C.随阴极析出 ,推测②中溶液 ,推测②中溶液 减少, 减少, 平衡逆移 平衡逆移 |
D.②中 生成 生成 ,使得 ,使得 比①中溶液的小, 比①中溶液的小, 缓慢析出,镀层更致密 缓慢析出,镀层更致密 |
5. 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应①完成之后,以
排放并实现资源利用,原理如图1所示。反应①完成之后,以 为载气,以恒定组成的
为载气,以恒定组成的 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳。
,在催化剂上有积碳。
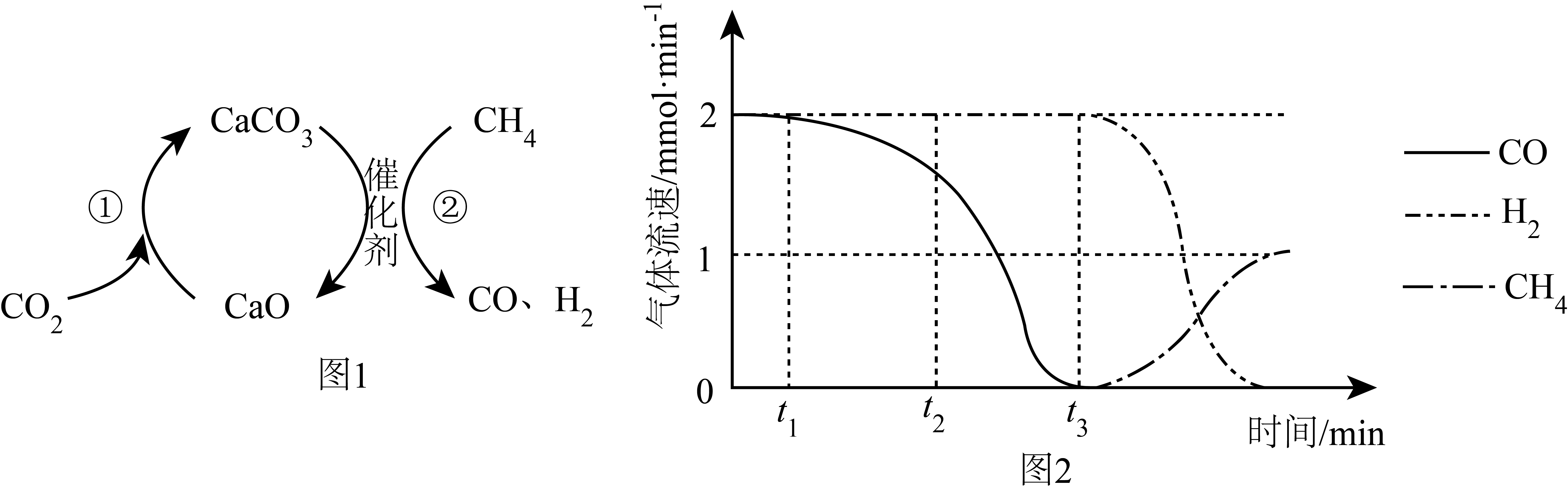
下列说法不正确 的是
 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应①完成之后,以
排放并实现资源利用,原理如图1所示。反应①完成之后,以 为载气,以恒定组成的
为载气,以恒定组成的 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳。
,在催化剂上有积碳。
下列说法
A.反应①为 ;反应②为 ;反应②为 |
B. , , 比 比 多,且生成 多,且生成 速率不变,可能有副反应 速率不变,可能有副反应 |
C. 时刻,副反应生成 时刻,副反应生成 的速率大于反应②生成 的速率大于反应②生成 速率 速率 |
D. 之后,生成 之后,生成 的速率为0,是因为反应②不再发生 的速率为0,是因为反应②不再发生 |
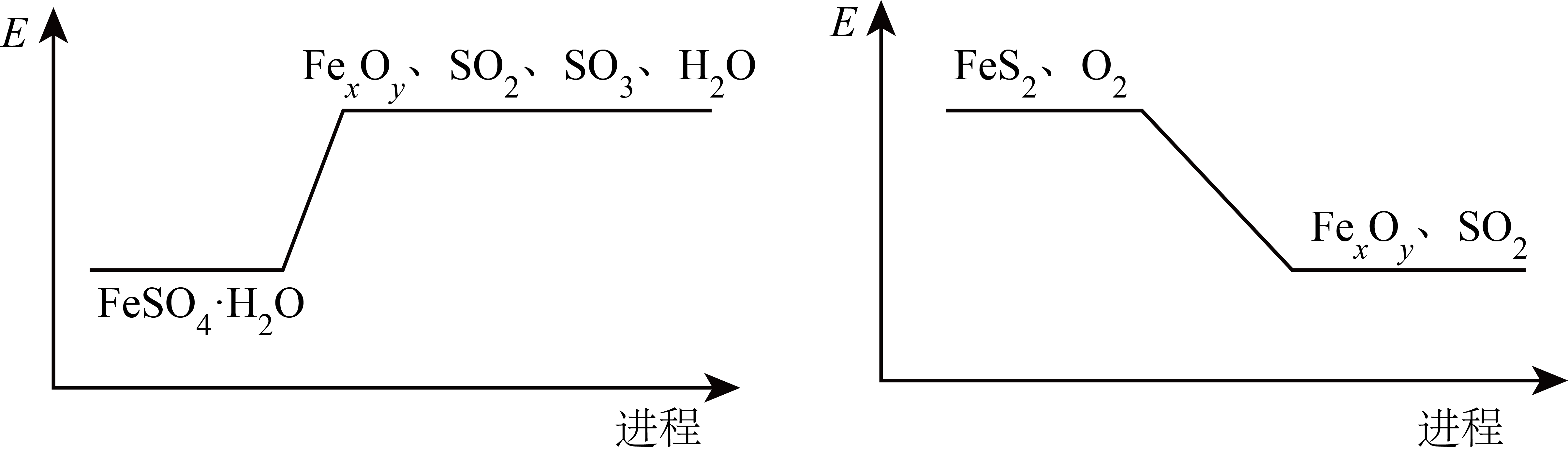
6.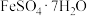 失水后可转为
失水后可转为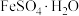 ,与
,与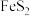 可联合制备铁粉精
可联合制备铁粉精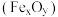 和
和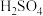 。
。
I.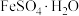 结构如图所示。
结构如图所示。

(1)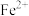 价层电子排布式为
价层电子排布式为___________ 。
(2)比较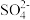 和
和 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:___________ 。
(3) 与
与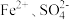 和
和 的作用分别为
的作用分别为___________ 。
II.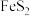 晶胞为立方体,边长为
晶胞为立方体,边长为 ,如图所示。
,如图所示。
(4)①与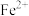 紧邻的阴离子个数为
紧邻的阴离子个数为___________ 。
②晶胞的密度为
___________ 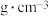 。
。

(5)以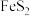 为燃料,配合
为燃料,配合 可以制备铁粉精
可以制备铁粉精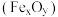 和
和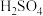 。结合图示解释可充分实现能源和资源有效利用的原因为
。结合图示解释可充分实现能源和资源有效利用的原因为___________ 。
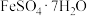 失水后可转为
失水后可转为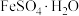 ,与
,与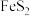 可联合制备铁粉精
可联合制备铁粉精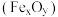 和
和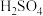 。
。I.
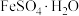 结构如图所示。
结构如图所示。
(1)
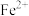 价层电子排布式为
价层电子排布式为(2)比较
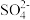 和
和 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:(3)
 与
与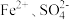 和
和 的作用分别为
的作用分别为II.
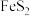 晶胞为立方体,边长为
晶胞为立方体,边长为 ,如图所示。
,如图所示。(4)①与
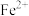 紧邻的阴离子个数为
紧邻的阴离子个数为②晶胞的密度为

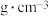 。
。

(5)以
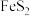 为燃料,配合
为燃料,配合 可以制备铁粉精
可以制备铁粉精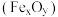 和
和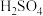 。结合图示解释可充分实现能源和资源有效利用的原因为
。结合图示解释可充分实现能源和资源有效利用的原因为
7.煤中硫的存在形态分为有机硫和无机硫( 、硫化物及微量单质硫等)。库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。
、硫化物及微量单质硫等)。库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。

已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含 。
。
(1)煤样需研磨成细小粉末,其目的是___________ 。
(2)高温下,煤中 完全转化为
完全转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)通过干燥装置后,待测气体进入库仑测硫仪进行测定。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中 保持定值时,电解池不工作。待测气体进入电解池后,
保持定值时,电解池不工作。待测气体进入电解池后, 溶解并将
溶解并将 还原,测硫仪便立即自动进行电解到
还原,测硫仪便立即自动进行电解到 又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。

① 在电解池中发生反应的离子方程式为
在电解池中发生反应的离子方程式为___________ 。
②测硫仪工作时电解池的阳极反应式为___________ 。
(4)煤样为 ,电解消耗的电量为x库仑,煤样中硫的质量分数为
,电解消耗的电量为x库仑,煤样中硫的质量分数为___________ 。
已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。
(5)条件控制和误差分析。
①测定过程中,需控制电解质溶液 ,当
,当 时,非电解生成的
时,非电解生成的 使得测得的全硫含量偏小,生成
使得测得的全硫含量偏小,生成 的离子方程式为
的离子方程式为___________ 。
②测定过程中,管式炉内壁上有 残留,测得全硫量结果为
残留,测得全硫量结果为___________ 。(填“偏大”或“偏小”)
 、硫化物及微量单质硫等)。库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。
、硫化物及微量单质硫等)。库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含
 。
。(1)煤样需研磨成细小粉末,其目的是
(2)高温下,煤中
 完全转化为
完全转化为 ,该反应的化学方程式为
,该反应的化学方程式为(3)通过干燥装置后,待测气体进入库仑测硫仪进行测定。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中
 保持定值时,电解池不工作。待测气体进入电解池后,
保持定值时,电解池不工作。待测气体进入电解池后, 溶解并将
溶解并将 还原,测硫仪便立即自动进行电解到
还原,测硫仪便立即自动进行电解到 又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
①
 在电解池中发生反应的离子方程式为
在电解池中发生反应的离子方程式为②测硫仪工作时电解池的阳极反应式为
(4)煤样为
 ,电解消耗的电量为x库仑,煤样中硫的质量分数为
,电解消耗的电量为x库仑,煤样中硫的质量分数为已知:电解中转移
 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。(5)条件控制和误差分析。
①测定过程中,需控制电解质溶液
 ,当
,当 时,非电解生成的
时,非电解生成的 使得测得的全硫含量偏小,生成
使得测得的全硫含量偏小,生成 的离子方程式为
的离子方程式为②测定过程中,管式炉内壁上有
 残留,测得全硫量结果为
残留,测得全硫量结果为8.碘番酸可用于X射线的口服造影液,其合成路线如图所示。
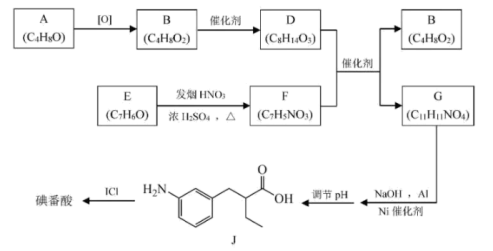
已知:R-COOH+R’-COOH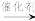
 +H2O
+H2O
(1)A可发生银镜反应,其官能团为___________ 。
(2)B无支链,B的名称为___________ 。B的一种同分异构体中只有一种环境氢,其结构简式为___________ 。
(3)E是芳香族化合物, 的方程式为
的方程式为___________ 。
(4)G中有乙基,则G的结构简式为___________ 。
(5)碘番酸中的碘在苯环不相邻的碳原了上,碘番酸的相对分了质量为571,J的相对分了质量为193。则碘番酸的结构简式为___________ 。
(6)通过滴定法来确定口服造影液中碘番酸的质量分数。
第一步 取 样品,加入过量
样品,加入过量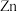 粉,
粉, 溶液后加热,将I元素全部转为
溶液后加热,将I元素全部转为 ,冷却,洗涤。
,冷却,洗涤。
第二步 调节溶液 ,用
,用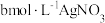 溶液滴定至终点,用去
溶液滴定至终点,用去 。已知口服造影液中无其他含碘物质,则碘番酸的质量分数为
。已知口服造影液中无其他含碘物质,则碘番酸的质量分数为___________ 。

已知:R-COOH+R’-COOH
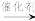
 +H2O
+H2O(1)A可发生银镜反应,其官能团为
(2)B无支链,B的名称为
(3)E是芳香族化合物,
 的方程式为
的方程式为(4)G中有乙基,则G的结构简式为
(5)碘番酸中的碘在苯环不相邻的碳原了上,碘番酸的相对分了质量为571,J的相对分了质量为193。则碘番酸的结构简式为
(6)通过滴定法来确定口服造影液中碘番酸的质量分数。
第一步 取
 样品,加入过量
样品,加入过量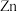 粉,
粉, 溶液后加热,将I元素全部转为
溶液后加热,将I元素全部转为 ,冷却,洗涤。
,冷却,洗涤。第二步 调节溶液
 ,用
,用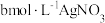 溶液滴定至终点,用去
溶液滴定至终点,用去 。已知口服造影液中无其他含碘物质,则碘番酸的质量分数为
。已知口服造影液中无其他含碘物质,则碘番酸的质量分数为9.铵浸法由白云石[主要成分为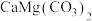 ,含
,含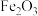 ,
, 杂质]制备高纯度碳酸钙和氧化镁。其流程如下:
杂质]制备高纯度碳酸钙和氧化镁。其流程如下:
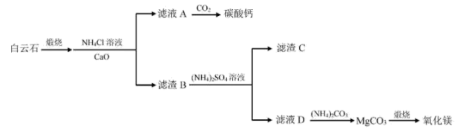
已知:
(1)煅烧白云石的化学方程式为___________ 。
(2)根据下表数据分析
已知:i.对浸出率给出定义
ii.对 给出定义
给出定义
①“沉钙”反应的化学方程式为___________ 。
②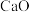 浸出率远高于
浸出率远高于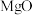 浸出率的原因为
浸出率的原因为___________ 。
③不宜选用的“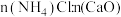 ”数值为
”数值为___________ 。
④ 实测值大于理论值的原因为
实测值大于理论值的原因为___________ 。
⑤蒸馏时,随馏出液体积增大,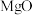 浸出率可出
浸出率可出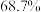 增加至
增加至 ,结合化学反应原理解释
,结合化学反应原理解释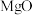 浸出率提高的原因为
浸出率提高的原因为___________ 。
(3)滤渣C为___________ 。
(4)可循环利用的物质为___________ 。
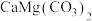 ,含
,含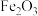 ,
, 杂质]制备高纯度碳酸钙和氧化镁。其流程如下:
杂质]制备高纯度碳酸钙和氧化镁。其流程如下:
已知:
| 物质 |  |  |  |  |
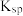 |  |  |  |  |
(1)煅烧白云石的化学方程式为
(2)根据下表数据分析
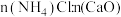 | 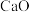 浸出率/ 浸出率/ | 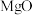 浸出率/ 浸出率/ |  理论值/ 理论值/ |  实测值/ 实测值/ |
 | 98.4 | 1.1 | 99.7 | - |
 | 98.8 | 1.5 | 99.2 | 99.5 |
 | 98.9 | 1.8 | 98.8 | 99.5 |
 | 99.1 | 6.0 | 95.6 | 97.6 |
已知:i.对浸出率给出定义
ii.对
 给出定义
给出定义①“沉钙”反应的化学方程式为
②
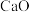 浸出率远高于
浸出率远高于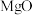 浸出率的原因为
浸出率的原因为③不宜选用的“
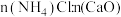 ”数值为
”数值为④
 实测值大于理论值的原因为
实测值大于理论值的原因为⑤蒸馏时,随馏出液体积增大,
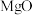 浸出率可出
浸出率可出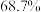 增加至
增加至 ,结合化学反应原理解释
,结合化学反应原理解释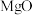 浸出率提高的原因为
浸出率提高的原因为(3)滤渣C为
(4)可循环利用的物质为
10.某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ii.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

(1)B中试剂是___________ 。
(2)通入Cl2前,II、III中沉淀由白色变为黑色的化学方程式为___________ 。
(3)对比实验I、II通入Cl2后的实验现象,对于二价锰化合物还原性的认识是___________ 。
(4)根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①化学方程式表示可能导致溶液碱性减弱的原因___________ ,但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被___________ (填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是___________ 。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因___________ 。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ii.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

| 序号 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| II | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| III | 40%NaOH 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,II、III中沉淀由白色变为黑色的化学方程式为
(3)对比实验I、II通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①化学方程式表示可能导致溶液碱性减弱的原因
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因
 搜索
搜索
 难度系数:0.65
难度系数:0.65  答案解析
答案解析
 有奖纠错
有奖纠错
