全一卷
1.生活中处处有化学,下列叙述正确的是
| A.HB铅笔芯的成分为二氧化铅 | B.碳酸氢钠可做食品膨松剂 |
| C.青铜和黄铜是不同结构的单质铜 | D.焰火中红色来源于钠盐灼烧 |
2.一种实现二氧化碳固定及再利用的反应如下:

下列叙述正确的是

下列叙述正确的是
| A.化合物1分子中的所有原子共平面 | B.化合物1与乙醇互为同系物 |
| C.化合物2分子中含有羟基和酯基 | D.化合物2可以发生开环聚合反应 |
3.某白色粉末样品,可能含有 、
、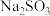 、
、 和
和 。取少量样品进行如下实验:
。取少量样品进行如下实验:
①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出。离心分离。
③取②的上层清液,向其中滴加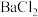 溶液有沉淀生成。
溶液有沉淀生成。
该样品中确定存在的是
 、
、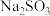 、
、 和
和 。取少量样品进行如下实验:
。取少量样品进行如下实验:①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出。离心分离。
③取②的上层清液,向其中滴加
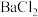 溶液有沉淀生成。
溶液有沉淀生成。该样品中确定存在的是
A. | B. | C. | D. |
4.由实验操作和现象,可得出相应正确结论的是
| 实验操作 | 现象 | 结论 | |
| A | 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液 | 先变橙色,后变蓝色 | 氧化性: |
| B | 向蔗糖溶液中滴加稀硫酸,水浴加热,加入少量新制的 悬浊液 悬浊液 | 无砖红色沉淀 | 蔗糖未发生水解 |
| C | 石蜡油加强热,将产生的气体通入 的 的 溶液 溶液 | 溶液红棕色变无色 | 气体中含有不饱和烃 |
| D | 加热试管中的聚氯乙烯薄膜碎片 | 试管口润湿的蓝色石蕊试纸变红 | 氯乙烯加聚是可逆反应 |
| A.A | B.B | C.C | D.D |
5.化合物 可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。
可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。 分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在
分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在 以下热分解时无刺激性气体逸出。下列叙述正确的是
以下热分解时无刺激性气体逸出。下列叙述正确的是

 可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。
可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。 分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在
分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在 以下热分解时无刺激性气体逸出。下列叙述正确的是
以下热分解时无刺激性气体逸出。下列叙述正确的是
| A.W、X、Y、Z的单质常温下均为气体 |
B.最高价氧化物的水化物的酸性: |
C. 阶段热分解失去4个 阶段热分解失去4个 |
D. 热分解后生成固体化合物 热分解后生成固体化合物 |
6. 电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电
电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电 电池(如图所示)。光照时,光催化电极产生电子
电池(如图所示)。光照时,光催化电极产生电子 和空穴
和空穴 ,驱动阴极反应
,驱动阴极反应 和阳极反应(Li2O2+2h+=2Li++O2)对电池进行充电。下列叙述错误的是
和阳极反应(Li2O2+2h+=2Li++O2)对电池进行充电。下列叙述错误的是

 电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电
电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电 电池(如图所示)。光照时,光催化电极产生电子
电池(如图所示)。光照时,光催化电极产生电子 和空穴
和空穴 ,驱动阴极反应
,驱动阴极反应 和阳极反应(Li2O2+2h+=2Li++O2)对电池进行充电。下列叙述错误的是
和阳极反应(Li2O2+2h+=2Li++O2)对电池进行充电。下列叙述错误的是
A.充电时,电池的总反应 |
| B.充电效率与光照产生的电子和空穴量有关 |
| C.放电时,Li+从正极穿过离子交换膜向负极迁移 |
D.放电时,正极发生反应 |
7.常温下,一元酸 的
的 。在某体系中,
。在某体系中, 与
与 离子不能穿过隔膜,未电离的
离子不能穿过隔膜,未电离的 可自由穿过该膜(如图所示)。
可自由穿过该膜(如图所示)。

设溶液中 ,当达到平衡时,下列叙述正确的是
,当达到平衡时,下列叙述正确的是
 的
的 。在某体系中,
。在某体系中, 与
与 离子不能穿过隔膜,未电离的
离子不能穿过隔膜,未电离的 可自由穿过该膜(如图所示)。
可自由穿过该膜(如图所示)。
设溶液中
 ,当达到平衡时,下列叙述正确的是
,当达到平衡时,下列叙述正确的是A.溶液Ⅰ中 |
B.溶液Ⅱ中的HA的电离度 为 为 |
C.溶液Ⅰ和Ⅱ中的 不相等 不相等 |
D.溶液Ⅰ和Ⅱ中的 之比为 之比为 |
8.废旧铅蓄电池的铅膏中主要含有 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。

一些难溶电解质的溶度积常数如下表:
一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:
回答下列问题:
(1)在“脱硫”中 转化反应的离子方程式为
转化反应的离子方程式为________ ,用沉淀溶解平衡原理解释选择 的原因
的原因________ 。
(2)在“脱硫”中,加入 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是________ 。
(3)在“酸浸”中,除加入醋酸( ),还要加入
),还要加入 。
。
(ⅰ)能被 氧化的离子是
氧化的离子是________ ;
(ⅱ) 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为 ,其化学方程式为
,其化学方程式为________ ;
(ⅲ) 也能使
也能使 转化为
转化为 ,
, 的作用是
的作用是________ 。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是________ 。
(5)“沉铅”的滤液中,金属离子有________ 。
 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质 |
|
|
|
|
|
|
|
|
|
 如下表:
如下表:金属氢氧化物 |
|
|
|
|
开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中
 转化反应的离子方程式为
转化反应的离子方程式为 的原因
的原因(2)在“脱硫”中,加入
 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是(3)在“酸浸”中,除加入醋酸(
 ),还要加入
),还要加入 。
。(ⅰ)能被
 氧化的离子是
氧化的离子是(ⅱ)
 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为 ,其化学方程式为
,其化学方程式为(ⅲ)
 也能使
也能使 转化为
转化为 ,
, 的作用是
的作用是(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是
(5)“沉铅”的滤液中,金属离子有
9.二草酸合铜(Ⅱ)酸钾( )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸( )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由 配制Ⅰ中的
配制Ⅰ中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是________ (填仪器名称)。

(2)长期存放的 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是________ 。
(3)Ⅰ中的黑色沉淀是________ (写化学式)。
(4)Ⅱ中原料配比为 ,写出反应的化学方程式
,写出反应的化学方程式________ 。
(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入 应采取
应采取________ 的方法。
(6)Ⅲ中应采用________ 进行加热。
(7)Ⅳ中“一系列操作”包括________ 。
 )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:Ⅰ.取已知浓度的
 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。Ⅱ.向草酸(
 )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由
 配制Ⅰ中的
配制Ⅰ中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是
(2)长期存放的
 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是(3)Ⅰ中的黑色沉淀是
(4)Ⅱ中原料配比为
 ,写出反应的化学方程式
,写出反应的化学方程式(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入
 应采取
应采取(6)Ⅲ中应采用
(7)Ⅳ中“一系列操作”包括
10.油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①

②

③

计算 热分解反应④
热分解反应④ 的
的
________  。
。
(2)较普遍采用的 处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解
处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解 。相比克劳斯工艺,高温热分解方法的优点是
。相比克劳斯工艺,高温热分解方法的优点是________ ,缺点是________ 。
(3)在 、
、 反应条件下,将
反应条件下,将 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为________ ,平衡常数
________  。
。
(4)在 、
、 反应条件下,对于
反应条件下,对于 分别为
分别为 、
、 、
、 、
、 、
、 的
的 混合气,热分解反应过程中
混合气,热分解反应过程中 转化率随时间的变化如下图所示。
转化率随时间的变化如下图所示。

① 越小,
越小, 平衡转化率
平衡转化率________ ,理由是________ 。
② 对应图中曲线
对应图中曲线________ ,计算其在 之间,
之间, 分压的平均变化率为
分压的平均变化率为________  。
。
(1)已知下列反应的热化学方程式:
①


②


③


计算
 热分解反应④
热分解反应④ 的
的
 。
。(2)较普遍采用的
 处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解
处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解 。相比克劳斯工艺,高温热分解方法的优点是
。相比克劳斯工艺,高温热分解方法的优点是(3)在
 、
、 反应条件下,将
反应条件下,将 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为
 。
。(4)在
 、
、 反应条件下,对于
反应条件下,对于 分别为
分别为 、
、 、
、 、
、 、
、 的
的 混合气,热分解反应过程中
混合气,热分解反应过程中 转化率随时间的变化如下图所示。
转化率随时间的变化如下图所示。
①
 越小,
越小, 平衡转化率
平衡转化率②
 对应图中曲线
对应图中曲线 之间,
之间, 分压的平均变化率为
分压的平均变化率为 。
。11.卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有_______ ,其中能量较高的是_______ 。(填标号)
a.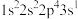 b.
b.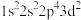 c.
c. d.
d.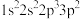
(2)①一氯乙烯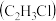 分子中,C的一个
分子中,C的一个_______ 杂化轨道与Cl的 轨道形成
轨道形成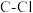
_______ 键,并且Cl的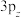 轨道与C的
轨道与C的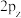 轨道形成3中心4电子的大
轨道形成3中心4电子的大 键
键 。
。
②一氯乙烷 、一氯乙烯
、一氯乙烯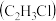 、一氯乙炔
、一氯乙炔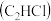 分子中,
分子中,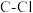 键长的顺序是
键长的顺序是_______ ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的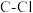 键越强;(ⅱ)
键越强;(ⅱ)_______ 。
(3)卤化物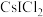 受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为
受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为_______ 。解释X的熔点比Y高的原因_______ 。
(4)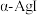 晶体中
晶体中 离子作体心立方堆积(如图所示),
离子作体心立方堆积(如图所示),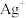 主要分布在由
主要分布在由 构成的四面体、八面体等空隙中。在电场作用下,
构成的四面体、八面体等空隙中。在电场作用下,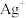 不需要克服太大的阻力即可发生迁移。因此,
不需要克服太大的阻力即可发生迁移。因此,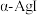 晶体在电池中可作为
晶体在电池中可作为_______ 。
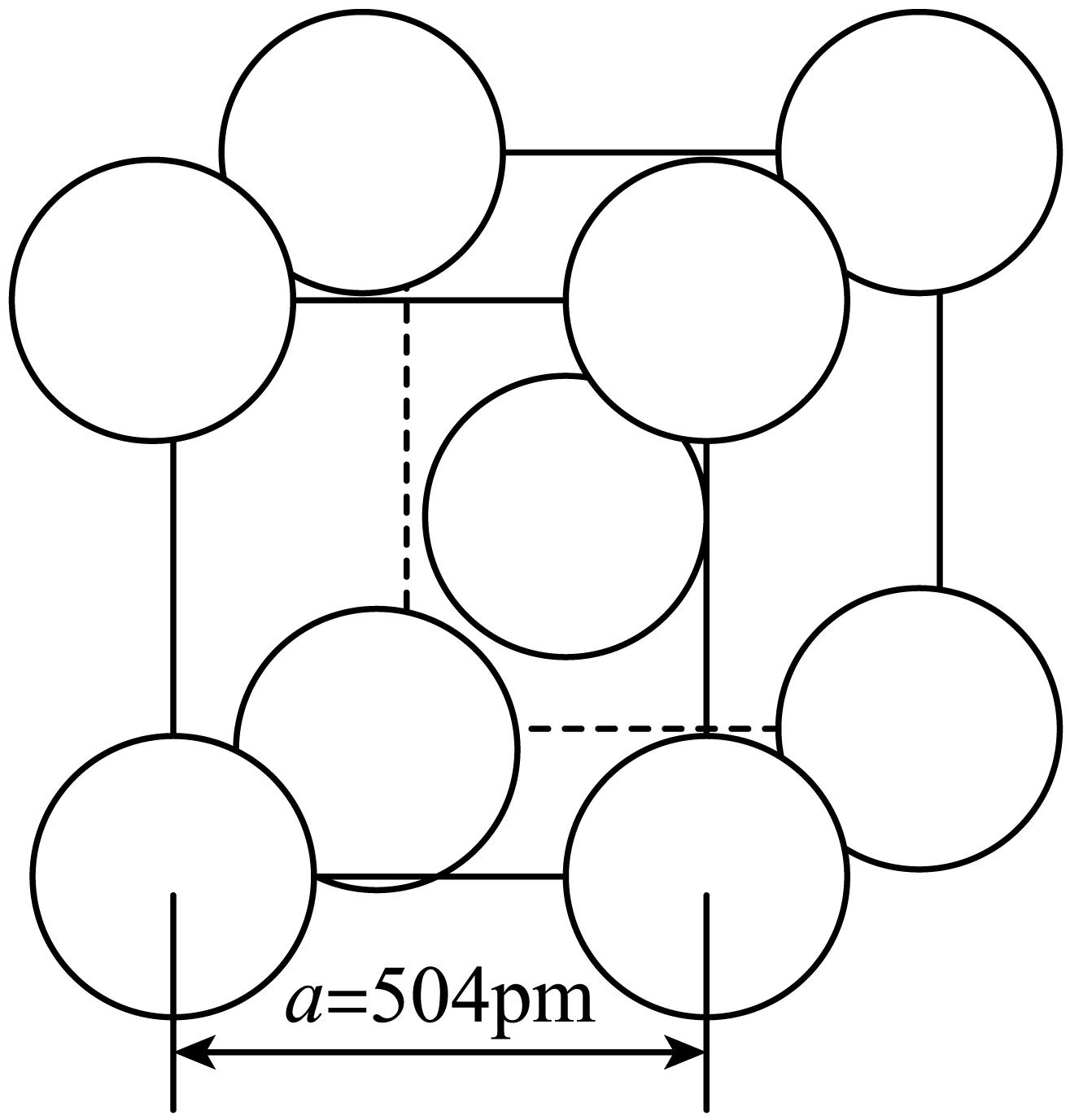
已知阿伏加德罗常数为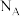 ,则
,则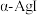 晶体的摩尔体积
晶体的摩尔体积
_______  (列出算式)。
(列出算式)。
(1)氟原子激发态的电子排布式有
a.
 b.
b.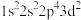 c.
c. d.
d.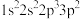
(2)①一氯乙烯
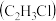 分子中,C的一个
分子中,C的一个 轨道形成
轨道形成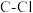
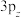 轨道与C的
轨道与C的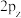 轨道形成3中心4电子的大
轨道形成3中心4电子的大 键
键 。
。②一氯乙烷
 、一氯乙烯
、一氯乙烯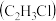 、一氯乙炔
、一氯乙炔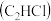 分子中,
分子中,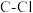 键长的顺序是
键长的顺序是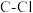 键越强;(ⅱ)
键越强;(ⅱ)(3)卤化物
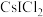 受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为
受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为(4)
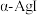 晶体中
晶体中 离子作体心立方堆积(如图所示),
离子作体心立方堆积(如图所示),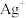 主要分布在由
主要分布在由 构成的四面体、八面体等空隙中。在电场作用下,
构成的四面体、八面体等空隙中。在电场作用下,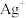 不需要克服太大的阻力即可发生迁移。因此,
不需要克服太大的阻力即可发生迁移。因此,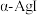 晶体在电池中可作为
晶体在电池中可作为
已知阿伏加德罗常数为
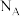 ,则
,则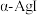 晶体的摩尔体积
晶体的摩尔体积
 (列出算式)。
(列出算式)。12.左旋米那普伦是治疗成人重度抑郁症的药物之一,以下是其盐酸盐(化合物K)的一种合成路线(部分反应条件已简化,忽略立体化学):

已知:化合物F不能与饱和碳酸氢钠溶液反应产生二氧化碳。
回答下列问题:
(1)A的化学名称是_______ 。
(2)C的结构简式为_______ 。
(3)写出由E生成F反应的化学方程式_______ 。
(4)E中含氧官能团的名称为_______ 。
(5)由G生成H的反应类型为_______ 。
(6)I是一种有机物形成的盐,结构简式为_______ 。
(7)在E的同分异构体中,同时满足下列条件的总数为_______ 种。
a)含有一个苯环和三个甲基;
b)与饱和碳酸氢钠溶液反应产生二氧化碳;
c)能发生银镜反应,不能发生水解反应。
上述同分异构体经银镜反应后酸化,所得产物中,核磁共振氢谱显示有四组氢(氢原子数量比为6:3:2:1)的结构简式为_______ 。

已知:化合物F不能与饱和碳酸氢钠溶液反应产生二氧化碳。
回答下列问题:
(1)A的化学名称是
(2)C的结构简式为
(3)写出由E生成F反应的化学方程式
(4)E中含氧官能团的名称为
(5)由G生成H的反应类型为
(6)I是一种有机物形成的盐,结构简式为
(7)在E的同分异构体中,同时满足下列条件的总数为
a)含有一个苯环和三个甲基;
b)与饱和碳酸氢钠溶液反应产生二氧化碳;
c)能发生银镜反应,不能发生水解反应。
上述同分异构体经银镜反应后酸化,所得产物中,核磁共振氢谱显示有四组氢(氢原子数量比为6:3:2:1)的结构简式为
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错











