全一卷
1.下列说法错误的是
| A.纯铁比生铁易生锈 | B.臭氧可用于自来水消毒 |
| C.酚醛树脂可用作绝缘、隔热材料 | D.高纯硅可用于制芯片 |
2.下列化学用语使用正确的是
A.基态C原子价电子排布图: | B.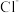 结构示意图: 结构示意图: |
C. 形成过程: 形成过程: | D.质量数为2的氢核素: |
3.《天工开物》中记载:“凡乌金纸由苏、杭造成,其纸用东海巨竹膜为质。用豆油点灯,闭塞周围,只留针孔通气,熏染烟光而成此纸,每纸一张打金箔五十度……”下列说法错误的是
| A.“乌金纸”的“乌”与豆油不完全燃烧有关 |
| B.“巨竹膜”为造纸的原料,主要成分是纤维素 |
| C.豆油的主要成分属于天然高分子化合物 |
| D.打金成箔,说明金具有良好的延展性 |
4.下列说法正确的是
A. (标准状况)与水充分反应转移 (标准状况)与水充分反应转移 电子 电子 |
B.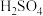 和 和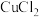 均可通过化合反应得到 均可通过化合反应得到 |
| C.将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 |
D. 与 与 溶液反应: 溶液反应: |
5.有机物a、b、c的结构如图。下列说法正确的是


| A.a的一氯代物有3种 | B.b是 的单体 的单体 |
C.c中碳原子的杂化方式均为 | D.a、b、c互为同分异构体 |
6.我国科技工作者发现某“小分子胶水”(结构如图)能助力自噬细胞“吞没”致病蛋白。下列说法正确的是


| A.该分子中所有碳原子一定共平面 | B.该分子能与蛋白质分子形成氢键 |
C. 该物质最多能与 该物质最多能与 反应 反应 | D.该物质能发生取代、加成和消去反应 |
7.单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是


| A.S位于元素周期表p区 | B.该物质的化学式为 |
| C.S位于H构成的八面体空隙中 | D.该晶体属于分子晶体 |
8.含S元素的某钠盐a能发生如图转化。下列说法错误的是
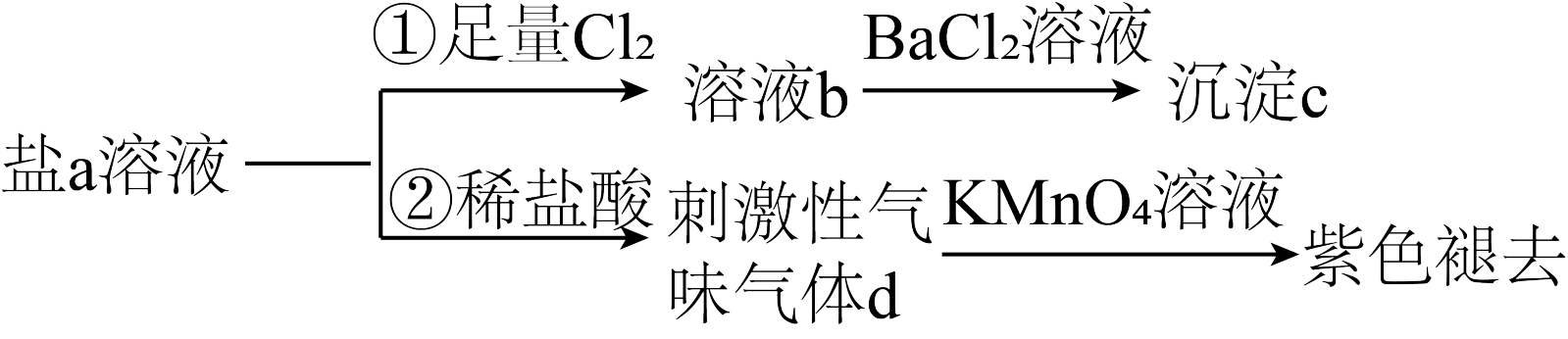
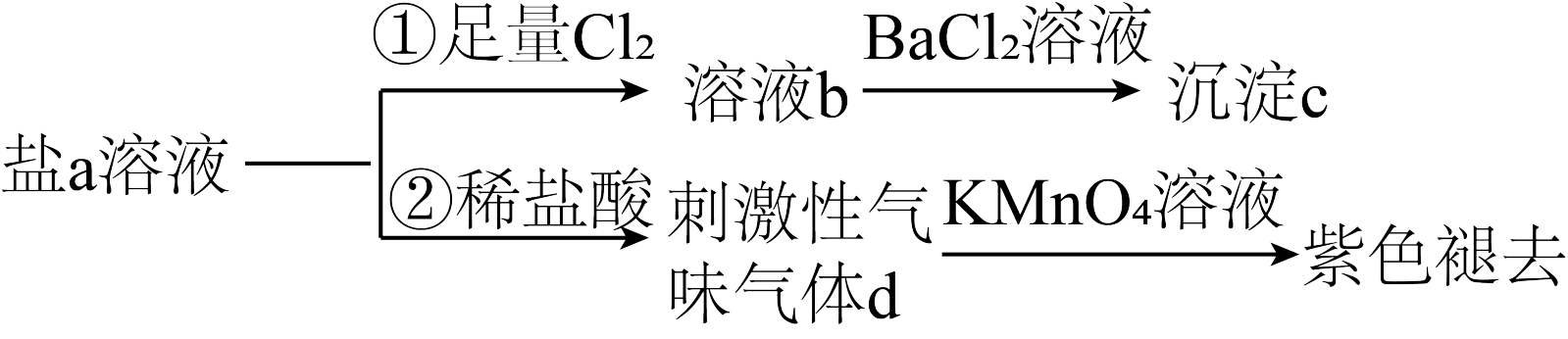
| A.a可能为正盐,也可能为酸式盐 | B.c为不溶于盐酸的白色沉淀 |
| C.d为含极性键的非极性分子 | D.反应②中还可能生成淡黄色沉淀 |
9.由下列实验操作及现象能得出相应结论的是
| 实验操作 | 现象 | 结论 | |
| A | 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡,静置 | 溶液分层,下层呈紫红色 | 氧化性: |
| B | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| C | 用pH计测定pH:①NaHCO3溶液②CH3COONa溶液 | pH:①>② | H2CO3酸性弱于CH3COOH |
| D | 把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口 | 木条复燃 | 反应生成了O2 |
| A.A | B.B | C.C | D.D |
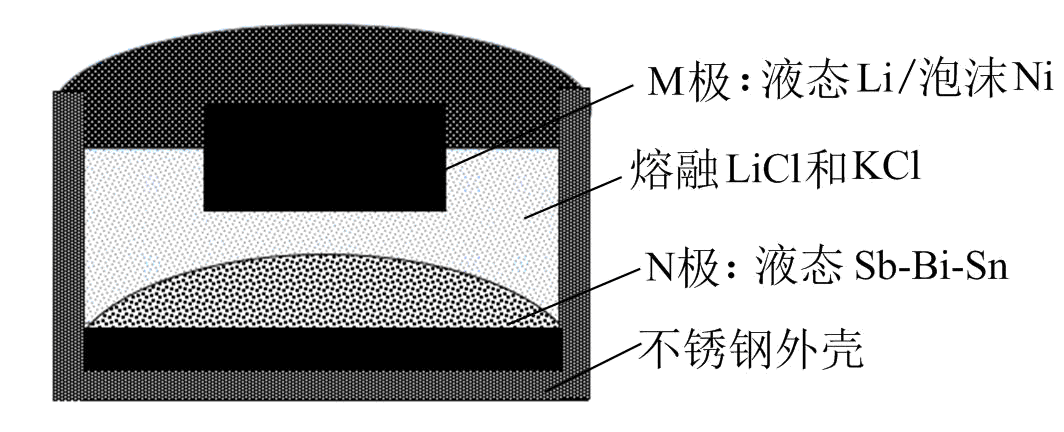
10.如图,某液态金属储能电池放电时产生金属化合物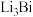 。下列说法正确的是
。下列说法正确的是
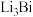 。下列说法正确的是
。下列说法正确的是
A.放电时,M电极反应为 |
B.放电时,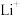 由M电极向N电极移动 由M电极向N电极移动 |
| C.充电时,M电极的质量减小 |
D.充电时,N电极反应为 |
11.某温度下,在恒容密闭容器中加入一定量X,发生反应 ,一段时间后达到平衡。下列说法错误的是
,一段时间后达到平衡。下列说法错误的是
 ,一段时间后达到平衡。下列说法错误的是
,一段时间后达到平衡。下列说法错误的是A.升高温度,若 增大,则 增大,则 |
B.加入一定量Z,达新平衡后 减小 减小 |
C.加入等物质的量的Y和Z,达新平衡后 增大 增大 |
| D.加入一定量氩气,平衡不移动 |
12.某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是


| A.其他条件相同时,催化剂浓度越大,反应速率越大 |
| B.其他条件相同时,降冰片烯浓度越大,反应速率越大 |
C.条件①,反应速率为 |
D.条件②,降冰片烯起始浓度为 时,半衰期为 时,半衰期为 |
13.利用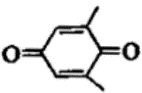 (Q)与
(Q)与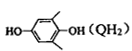 电解转化法从烟气中分离
电解转化法从烟气中分离 的原理如图。已知气体可选择性通过膜电极,溶液不能通过。下列说法错误的是
的原理如图。已知气体可选择性通过膜电极,溶液不能通过。下列说法错误的是

 (Q)与
(Q)与 电解转化法从烟气中分离
电解转化法从烟气中分离 的原理如图。已知气体可选择性通过膜电极,溶液不能通过。下列说法错误的是
的原理如图。已知气体可选择性通过膜电极,溶液不能通过。下列说法错误的是
| A.a为电源负极 | B.溶液中Q的物质的量保持不变 |
C. 在M极被还原 在M极被还原 | D.分离出的 从出口2排出 从出口2排出 |
14.某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是


A.氢化物沸点: | B.原子半径: |
C.第一电离能: | D.阴、阳离子中均有配位键 |
15.用 盐酸滴定
盐酸滴定 溶液,溶液中
溶液,溶液中 、
、 、
、 的分布分数
的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是【如
随pH变化曲线及滴定曲线如图。下列说法正确的是【如 分布分数:
分布分数: 】
】

 盐酸滴定
盐酸滴定 溶液,溶液中
溶液,溶液中 、
、 、
、 的分布分数
的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是【如
随pH变化曲线及滴定曲线如图。下列说法正确的是【如 分布分数:
分布分数: 】
】
A. 的 的 为 为 | B.c点: |
| C.第一次突变,可选酚酞作指示剂 | D. |
16.从钒铬锰矿渣(主要成分为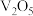 、
、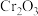 、
、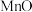 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下:
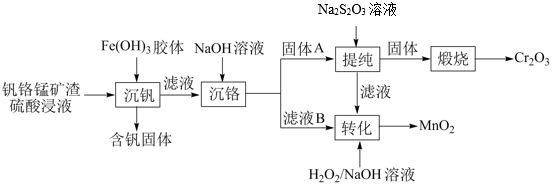
已知:pH较大时,二价锰[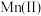 ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:
(1)Cr元素位于元素周期表第_______ 周期_______ 族。
(2)用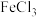 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为_______ 。
(3)常温下,各种形态五价钒粒子总浓度的对数[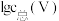 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中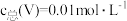 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为_______ (填化学式)。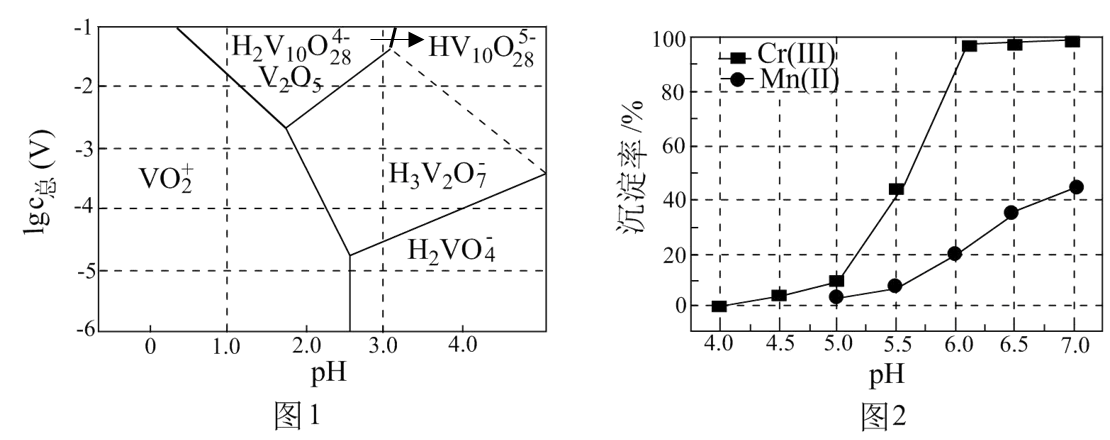
(4)某温度下,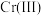 、
、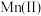 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为_______ ;在该条件下滤液B中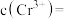
_______  【
【 近似为
近似为 ,
, 的
的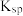 近似为
近似为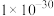 】。
】。
(5)“转化”过程中生成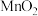 的离子方程式为
的离子方程式为_______ 。
(6)“提纯”过程中 的作用为
的作用为_______ 。
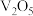 、
、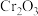 、
、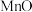 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下:
已知:pH较大时,二价锰[
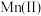 ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:(1)Cr元素位于元素周期表第
(2)用
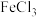 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为(3)常温下,各种形态五价钒粒子总浓度的对数[
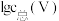 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中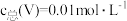 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为
(4)某温度下,
 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为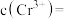
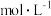 【
【 近似为
近似为 ,
, 的
的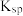 近似为
近似为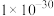 】。
】。(5)“转化”过程中生成
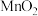 的离子方程式为
的离子方程式为(6)“提纯”过程中
 的作用为
的作用为17.苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:
Ⅰ.主反应: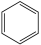 (g)+3H2(g)⇌
(g)+3H2(g)⇌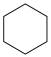 (g) ∆H1<0
(g) ∆H1<0
Ⅱ.副反应: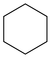 (g) ⇌
(g) ⇌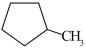 (g) ∆H2>0
(g) ∆H2>0
回答下列问题:
(1)已知:Ⅲ.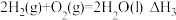
Ⅳ.2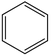 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
Ⅴ.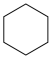 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
则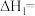
_______ (用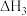 、
、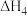 和
和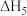 表示)。
表示)。
(2)有利于提高平衡体系中环己烷体积分数的措施有_______。
(3)反应Ⅰ在管式反应器中进行,实际投料往往在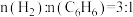 的基础上适当增大
的基础上适当增大 用量,其目的是
用量,其目的是_______ 。
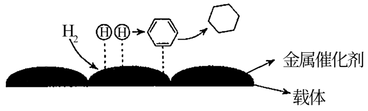
(4)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当 中混有微量
中混有微量 或
或 等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为
等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为_______ 。
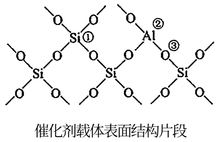
(5)催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合孤电子对,下图中可作为酸性中心的原子的标号是_______ (填“①”“②”或“③”)。
(6)恒压反应器中,按照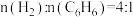 投料,发生Ⅰ、Ⅱ反应,总压为
投料,发生Ⅰ、Ⅱ反应,总压为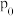 ,平衡时苯的转化率为α,环己烷的分压为p,则反应1的
,平衡时苯的转化率为α,环己烷的分压为p,则反应1的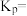
_______ (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅰ.主反应:
 (g)+3H2(g)⇌
(g)+3H2(g)⇌ (g) ∆H1<0
(g) ∆H1<0Ⅱ.副反应:
 (g) ⇌
(g) ⇌ (g) ∆H2>0
(g) ∆H2>0回答下列问题:
(1)已知:Ⅲ.
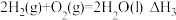
Ⅳ.2
 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4Ⅴ.
 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5则
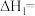
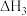 、
、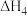 和
和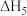 表示)。
表示)。(2)有利于提高平衡体系中环己烷体积分数的措施有_______。
| A.适当升温 | B.适当降温 | C.适当加压 | D.适当减压 |
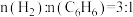 的基础上适当增大
的基础上适当增大 用量,其目的是
用量,其目的是(4)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当
 中混有微量
中混有微量 或
或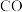 等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为
等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为
(5)催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合孤电子对,下图中可作为酸性中心的原子的标号是

(6)恒压反应器中,按照
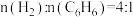 投料,发生Ⅰ、Ⅱ反应,总压为
投料,发生Ⅰ、Ⅱ反应,总压为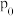 ,平衡时苯的转化率为α,环己烷的分压为p,则反应1的
,平衡时苯的转化率为α,环己烷的分压为p,则反应1的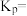
18. 磁性材料在很多领域具有应用前景,其制备过程如下(各步均在
磁性材料在很多领域具有应用前景,其制备过程如下(各步均在 氛围中进行):
氛围中进行):
①称取 ,配成
,配成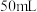 溶液,转移至恒压滴液漏斗中。
溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入 溶液。
溶液。
③持续磁力搅拌,将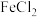 溶液以
溶液以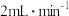 的速度全部滴入三颈烧瓶中,100℃下回流3h。
的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在 干燥。
干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
(1)仪器a的名称是_______ ;使用恒压滴液漏斗的原因是_______ 。
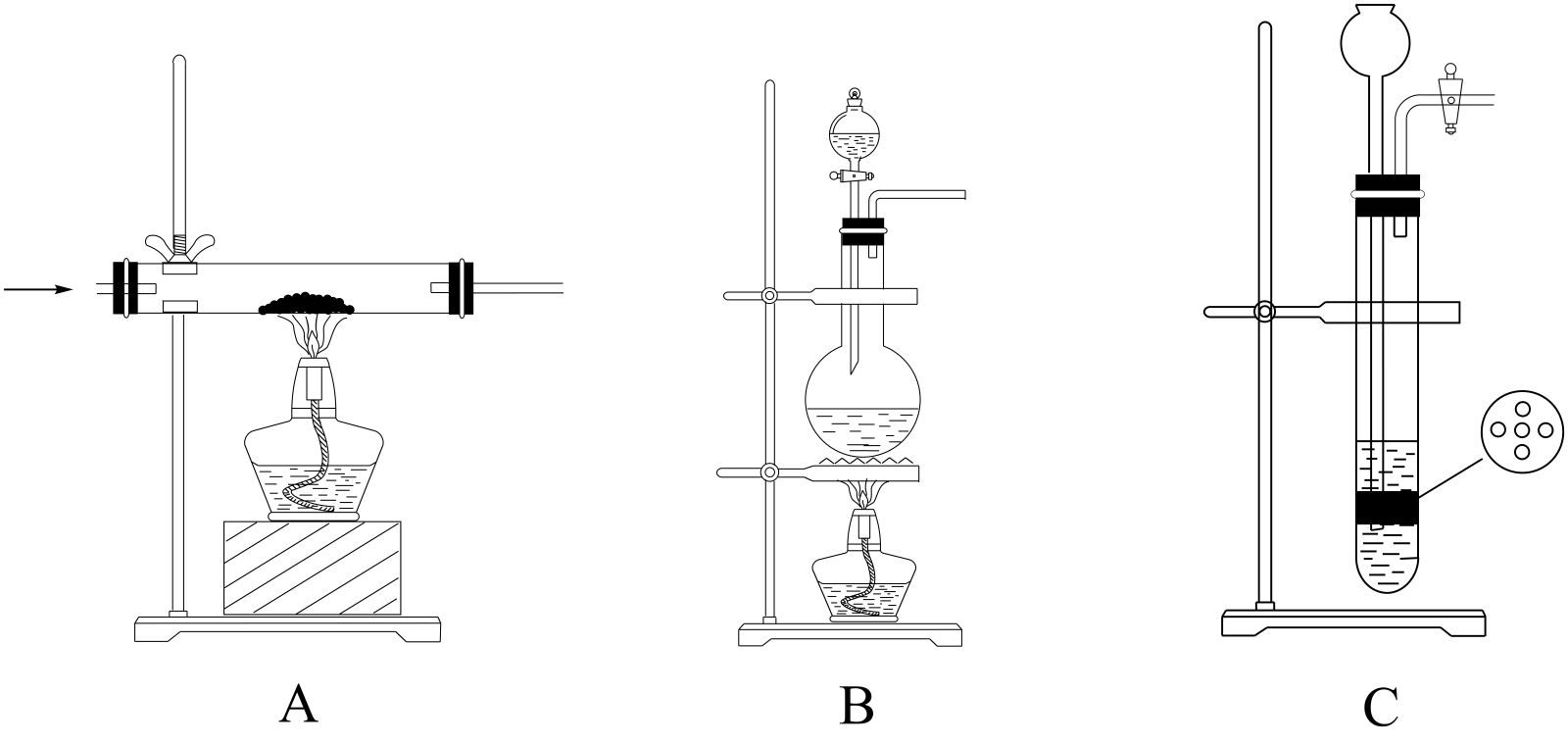
(2)实验室制取 有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为
有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为_______ ,对应的装置为_______ (填标号)。
可供选择的试剂: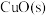 、
、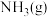 、
、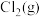 、
、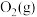 、饱和
、饱和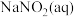 、饱和
、饱和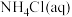
可供选择的发生装置(净化装置略去):
(3)三颈烧瓶中反应生成了Fe和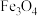 ,离子方程式为
,离子方程式为_______ 。
(4)为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。
(5)步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为_______ ;使用乙醇洗涤的目的是_______ 。
(6)该实验所得磁性材料的产率为_______ (保留3位有效数字)。
 磁性材料在很多领域具有应用前景,其制备过程如下(各步均在
磁性材料在很多领域具有应用前景,其制备过程如下(各步均在 氛围中进行):
氛围中进行):①称取
 ,配成
,配成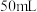 溶液,转移至恒压滴液漏斗中。
溶液,转移至恒压滴液漏斗中。②向三颈烧瓶中加入
 溶液。
溶液。③持续磁力搅拌,将
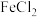 溶液以
溶液以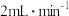 的速度全部滴入三颈烧瓶中,100℃下回流3h。
的速度全部滴入三颈烧瓶中,100℃下回流3h。④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在
 干燥。
干燥。⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
(1)仪器a的名称是
(2)实验室制取
 有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为
有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为可供选择的试剂:
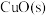 、
、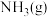 、
、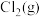 、
、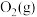 、饱和
、饱和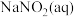 、饱和
、饱和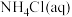
可供选择的发生装置(净化装置略去):

(3)三颈烧瓶中反应生成了Fe和
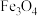 ,离子方程式为
,离子方程式为(4)为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。
| A.采用适宜的滴液速度 | B.用盐酸代替KOH溶液,抑制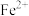 水解 水解 |
| C.在空气氛围中制备 | D.选择适宜的焙烧温度 |
(6)该实验所得磁性材料的产率为
19.中华裸蒴中含有一种具有杀菌活性的化合物J,其合成路线如下:
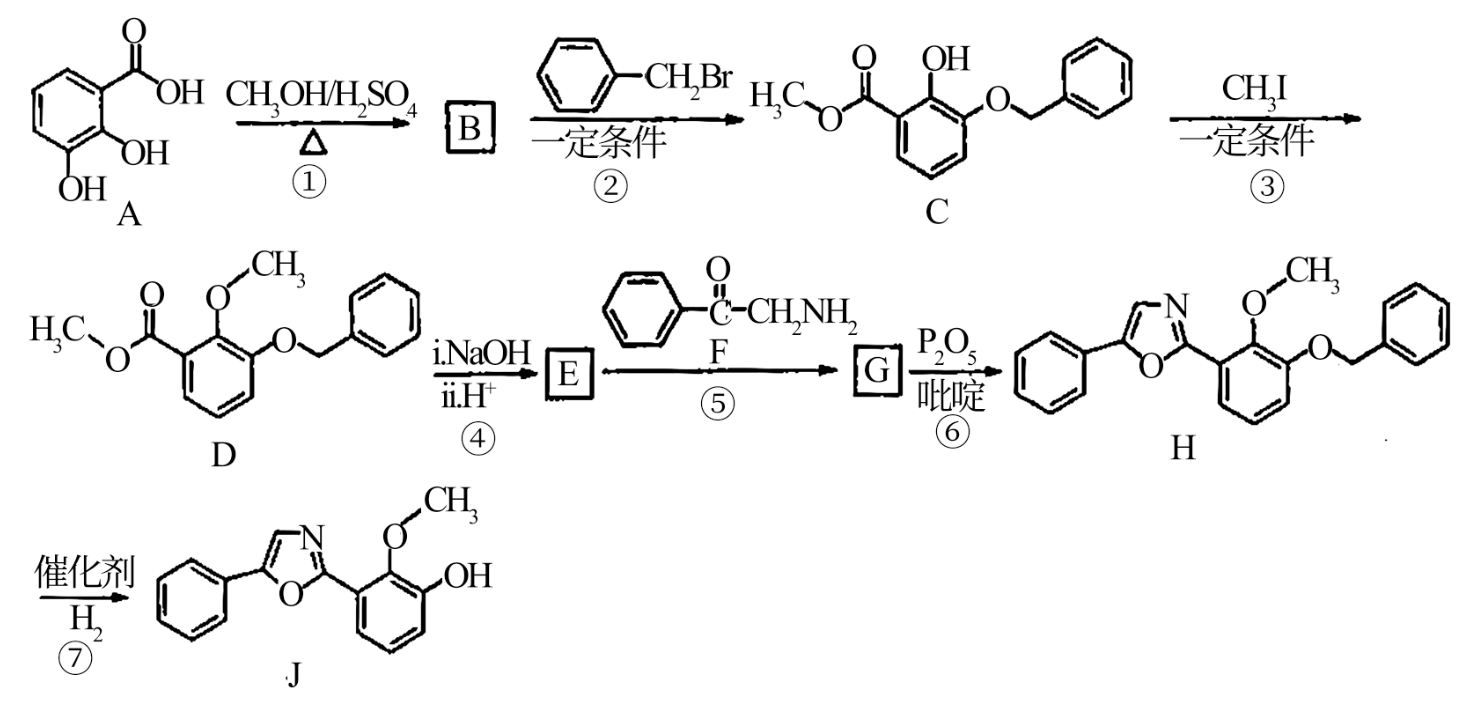
已知: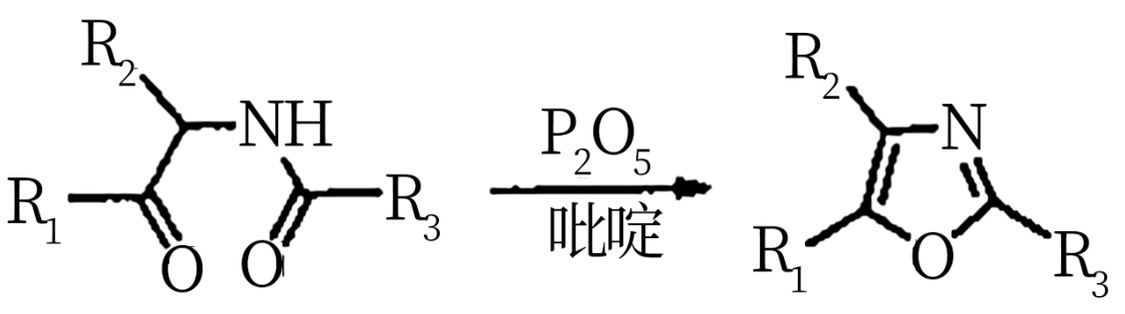
回答下列问题:
(1)D中含氧官能团的名称为_______ ;J的分子式为_______ 。
(2)A的两种同分异构体结构分别为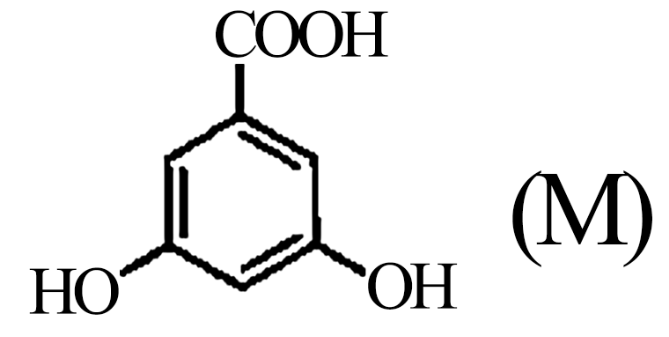 和
和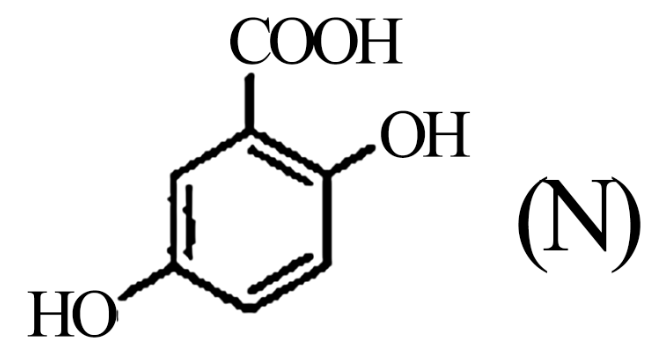 ,其熔点M
,其熔点M_______ N(填“高于”或“低于”)。
(3)由A生成B的化学方程式为_______ 。
(4)由B生成C的反应类型为_______ 。
(5)G的结构简式为_______ 。
(6)F的同分异构体中,含有苯环、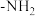 ,且能发生银镜反应的有
,且能发生银镜反应的有_______ 种;其中核磁共振氢谱峰面积之比为2∶2∶2∶2∶1的同分异构体的结构简式为_______ 。

已知:

回答下列问题:
(1)D中含氧官能团的名称为
(2)A的两种同分异构体结构分别为
 和
和 ,其熔点M
,其熔点M(3)由A生成B的化学方程式为
(4)由B生成C的反应类型为
(5)G的结构简式为
(6)F的同分异构体中,含有苯环、
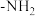 ,且能发生银镜反应的有
,且能发生银镜反应的有 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
