全一卷
1.近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误 的是
| A.北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素 |
| B.奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料 |
| C.长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应 |
| D.天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料 |
2.下列各组物质的晶体类型相同的是
| A.SiO2和SO3 | B.I2和NaCl | C.Cu和Ag | D.SiC和MgO |
3.核聚变发电有望成为解决人类能源问题的重要手段之一、氘( )是核聚变反应的主要原料,下列有关叙述正确的是
)是核聚变反应的主要原料,下列有关叙述正确的是
 )是核聚变反应的主要原料,下列有关叙述正确的是
)是核聚变反应的主要原料,下列有关叙述正确的是A. 的中子数为2 的中子数为2 | B. 的核电荷数为1 的核电荷数为1 |
C. 是自然界中最轻的原子 是自然界中最轻的原子 | D. 是氢元素的一种同素异形体 是氢元素的一种同素异形体 |
4.关于反应 所涉及的物质,下列说法
所涉及的物质,下列说法错误 的是
 所涉及的物质,下列说法
所涉及的物质,下列说法| A.H2SO4在该反应中为氧化剂 | B.Na2SO3容易被空气中的O2氧化变质 |
| C.Na2SO4是含有共价键的离子化合物 | D.SO2是导致酸雨的主要有害污染物 |
5.下列化学用语表达正确的是
A.F-的离子结构示意图: |
B.基态碳原子的轨道表示式: |
C.丙炔的键线式: |
D.H2O分子的球棍模型: |
6.进行下列实验操作时,选用仪器正确的是
| 提取碘水中的碘 | 量取一定体积的KMnO4溶液 | 熔化NaOH固体 | 浓缩NaCl溶液 |
 |  |  |  |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
7.设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1mol/LHCl溶液中,HCl分子的数目为NA |
| B.22.4L氢气中,H2分子的数目为NA |
| C.180g葡萄糖中,C原子的数目为6NA |
| D.1molN2中,σ键的数目为3NA |
8.最理想的“原子经济性反应”是指反应物的原子全部转化为期望的最终产物的反应。下列属于最理想的“原子经济性反应”的是
| A.用电石与水制备乙炔的反应 |
| B.用溴乙烷与NaOH的乙醇溶液共热制备乙烯的反应 |
| C.用苯酚稀溶液与饱和溴水制备2,4,6-三溴苯酚的反应 |
D.用乙烯与氧气在Ag催化下制备环氧乙烷( )的反应 )的反应 |
9.常温下,下列各组离子在给定溶液中能大量共存的是
A.pH=1的溶液:Fe2+、Mg2+、 、 、 |
B.pH=12的溶液:K+、Na+、 、 、 |
| C.pH=7的溶液:Na+、Cu2+、S2-、Cl- |
D.pH=7的溶液:Al3+、K+、Cl-、 |
10.常温下,下列有关电解质溶液的叙述正确的是
A.在 溶液中 溶液中 |
B.在 溶液中 溶液中 |
C.在 溶液中 溶液中 |
D.氨水和NH4Cl溶液混合,形成pH=9的溶液中 |
11.如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误 的是


| A.a是电源的负极 |
| B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色 |
| C.随着电解的进行,CuCl2溶液浓度变大 |
D.当 完全溶解时,至少产生气体336mL (折合成标准状况下) 完全溶解时,至少产生气体336mL (折合成标准状况下) |
12.元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是


| A.X的电负性比Q的大 |
| B.Q的简单离子半径比R的大 |
| C.Z的简单气态氢化物的热稳定性比Q的强 |
| D.Y的最高价氧化物对应的水化物的碱性比R的强 |
13.铁单质及其化合物的应用非常广泛。
(1)基态Fe原子的价层电子排布式为___________ 。
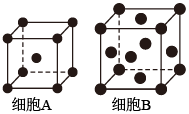
(2)用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为___________ 。每个晶胞B中含Fe原子数为___________ 。
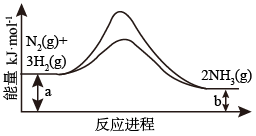
(3)合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式___________ 。从能量角度分析,铁触媒的作用是___________ 。
(4)Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如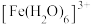 、
、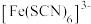 、
、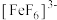 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验:
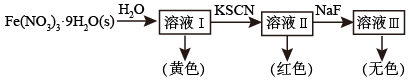
①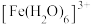 为浅紫色,但溶液Ⅰ却呈黄色,其原因是
为浅紫色,但溶液Ⅰ却呈黄色,其原因是___________ ,为了能观察到溶液Ⅰ中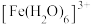 的浅紫色,可采取的方法是
的浅紫色,可采取的方法是___________ 。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡: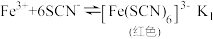 ;
;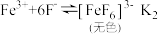 ,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为
,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为___________ ,平衡常数为___________ (用K1和K2表示)。
(1)基态Fe原子的价层电子排布式为
(2)用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为

(3)合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式

(4)Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如
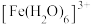 、
、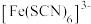 、
、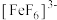 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验:
①
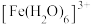 为浅紫色,但溶液Ⅰ却呈黄色,其原因是
为浅紫色,但溶液Ⅰ却呈黄色,其原因是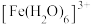 的浅紫色,可采取的方法是
的浅紫色,可采取的方法是②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡:
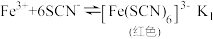 ;
;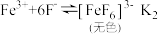 ,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为
,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为14.普瑞巴林能用于治疗多种疾病,结构简式为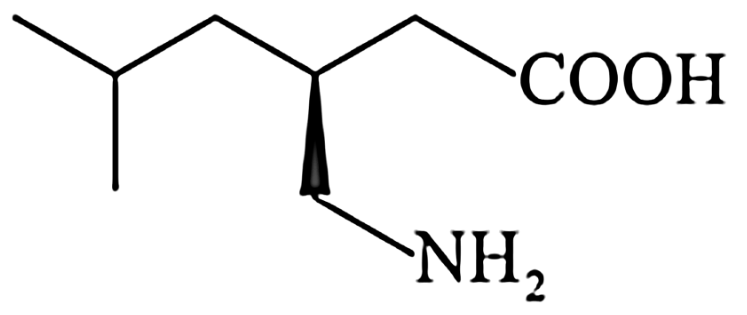 ,其合成路线如下:
,其合成路线如下:

(1)普瑞巴林分子所含官能团的名称为___________ 。
(2)化合物A的命名为___________ 。
(3)B→C的有机反应类型为___________ 。
(4)写出D→E的化学反应方程式___________ 。
(5)E~G中,含手性碳原子的化合物有___________ (填字母)。
(6)E→F反应所用的化合物X的分子式为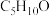 ,该化合物能发生银镜反应,写出其结构简式
,该化合物能发生银镜反应,写出其结构简式___________ ,化合物X的含有碳氧双键(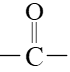 )的同分异构体(不包括X、不考虑立体异构)数目为
)的同分异构体(不包括X、不考虑立体异构)数目为___________ ,其中核磁共振氢谱中有两组峰的为___________ (写结构简式)。
(7)参考以上合成路线及反应条件,以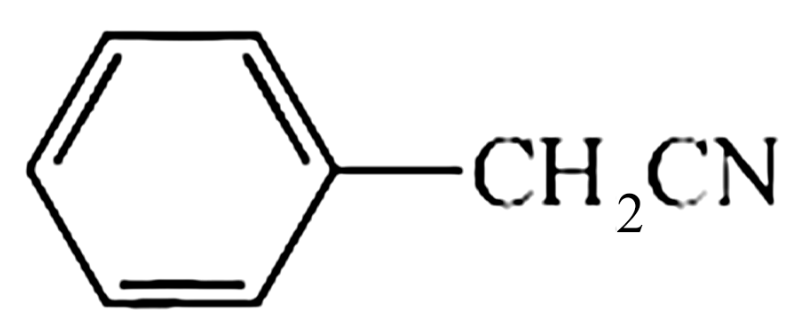 和必要的无机试剂为原料,合成
和必要的无机试剂为原料,合成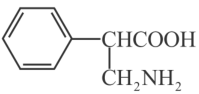 ,在方框中写出路线流程图。
,在方框中写出路线流程图。___________

 ,其合成路线如下:
,其合成路线如下:
(1)普瑞巴林分子所含官能团的名称为
(2)化合物A的命名为
(3)B→C的有机反应类型为
(4)写出D→E的化学反应方程式
(5)E~G中,含手性碳原子的化合物有
(6)E→F反应所用的化合物X的分子式为
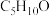 ,该化合物能发生银镜反应,写出其结构简式
,该化合物能发生银镜反应,写出其结构简式 )的同分异构体(不包括X、不考虑立体异构)数目为
)的同分异构体(不包括X、不考虑立体异构)数目为(7)参考以上合成路线及反应条件,以
 和必要的无机试剂为原料,合成
和必要的无机试剂为原料,合成 ,在方框中写出路线流程图。
,在方框中写出路线流程图。
15.某化学小组同学利用一定浓度的H2O2溶液制备O2,再用O2氧化C2H5OH,并检验氧化产物。
Ⅰ.制备O2
该小组同学设计了如下气体发生装置(夹持装置省略)
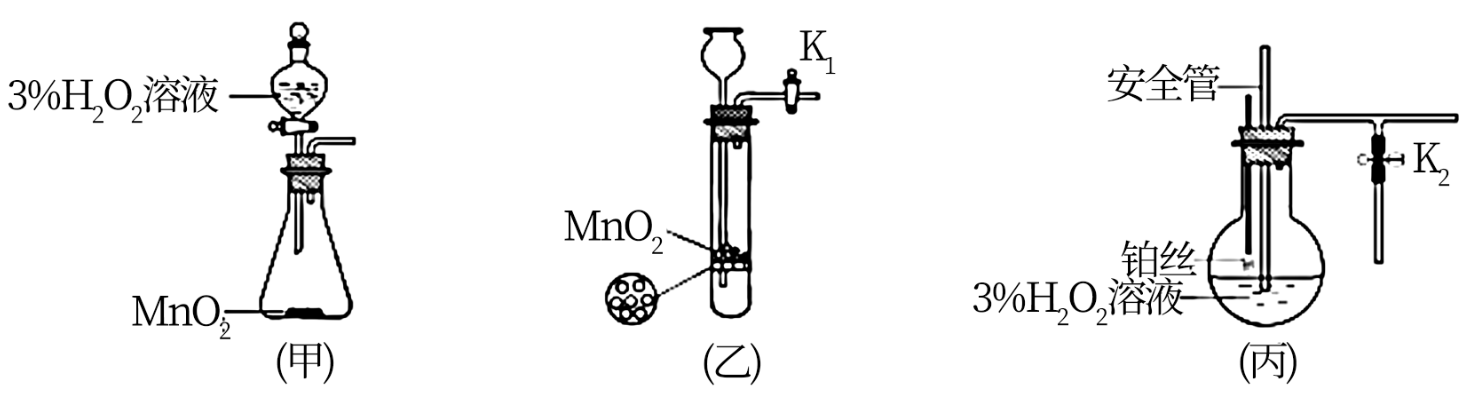
(1)甲装置中主要仪器的名称为___________ 。
(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至___________ 。欲使反应停止,关闭活塞K1即可,此时装置中的现象是___________ 。
(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是___________ ,此时可以将铂丝抽离H2O2溶液,还可以采取的安全措施是___________ 。
(4)丙装置的特点是___________ (填序号)。
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
Ⅱ.氧化C2H5OH
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)
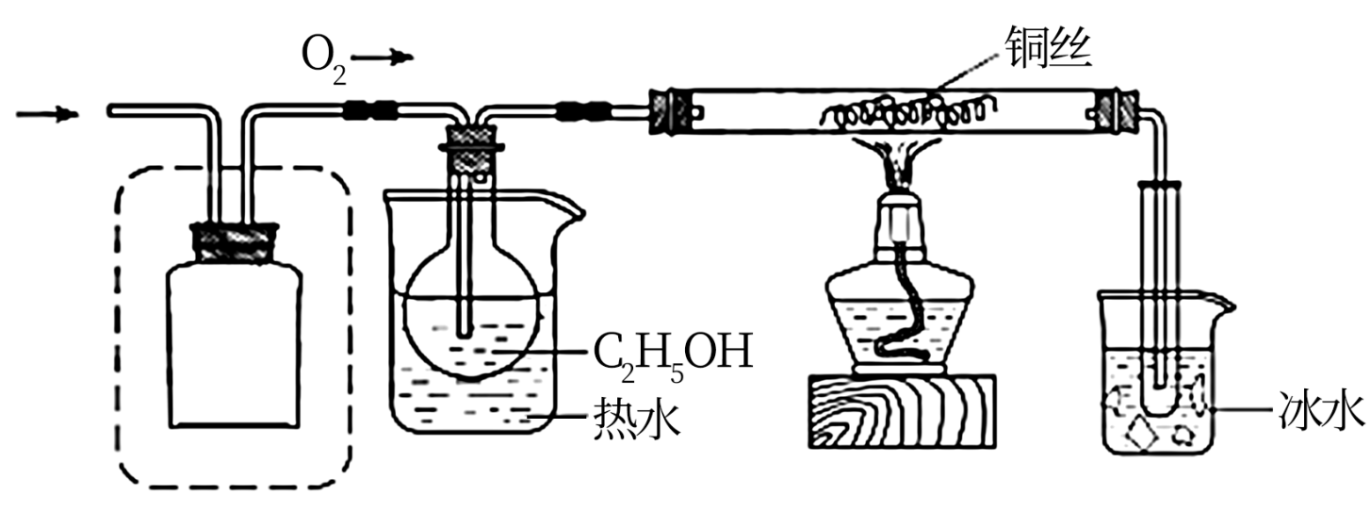
(5)在图中方框内补全干燥装置和干燥剂。___________
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验①~③中的结论不合理的是___________ (填序号),原因是___________ 。
Ⅰ.制备O2
该小组同学设计了如下气体发生装置(夹持装置省略)

(1)甲装置中主要仪器的名称为
(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至
(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
(4)丙装置的特点是
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
Ⅱ.氧化C2H5OH
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)

(5)在图中方框内补全干燥装置和干燥剂。
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
| 实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
| ① | 酸性KMnO4溶液 | 紫红色褪去 | 产物含有乙醛 |
| ② | 新制Cu(OH)2,加热 | 生成砖红色沉淀 | 产物含有乙醛 |
| ③ | 微红色含酚酞的NaOH溶液 | 微红色褪去 | 产物可能含有乙酸 |
实验①~③中的结论不合理的是
16.CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应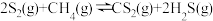 ,回答下列问题:
,回答下列问题:
(1)CH4的电子式为___________ ,CS2分子的立体构型为___________ 。
(2)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________ 。
②当以下数值不变时,能说明该反应达到平衡的是___________ (填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为___________ (填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________ 。
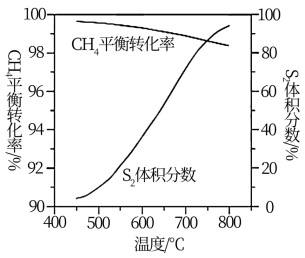
(4)用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式___________ 。
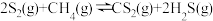 ,回答下列问题:
,回答下列问题:(1)CH4的电子式为
(2)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为
②当以下数值不变时,能说明该反应达到平衡的是
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为

(4)用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
