全一卷
1.我国提出争取在2030年前实现碳达峰,2060年实现碳中和,这对于改善环境,实现绿色发展至关重要。碳中和是指 的排放总量和减少总量相当。下列措施中能促进碳中和最直接有效的是
的排放总量和减少总量相当。下列措施中能促进碳中和最直接有效的是
 的排放总量和减少总量相当。下列措施中能促进碳中和最直接有效的是
的排放总量和减少总量相当。下列措施中能促进碳中和最直接有效的是| A.将重质油裂解为轻质油作为燃料 |
| B.大规模开采可燃冰作为新能源 |
| C.通过清洁煤技术减少煤燃烧污染 |
D.研发催化剂将 还原为甲醇 还原为甲醇 |
2.在实验室采用如图装置制备气体,合理的是


| 化学试剂 | 制备的气体 | |
| A |  | 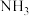 |
| B |  (浓) (浓) |  |
| C |  | 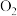 |
| D |  (浓) (浓) | 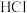 |
| A.A | B.B | C.C | D.D |
3.下列过程中的化学反应,相应的离子方程式正确的是
A.用碳酸钠溶液处理水垢中的硫酸钙: |
B.过量铁粉加入稀硝酸中: |
C.硫酸铝溶液中滴加少量氢氧化钾溶液: |
D.氯化铜溶液中通入硫化氢: |
4.一种活性物质的结构简式为 ,下列有关该物质的叙述正确的是
,下列有关该物质的叙述正确的是
 ,下列有关该物质的叙述正确的是
,下列有关该物质的叙述正确的是| A.能发生取代反应,不能发生加成反应 |
| B.既是乙醇的同系物也是乙酸的同系物 |
C.与 互为同分异构体 互为同分异构体 |
D. 该物质与碳酸钠反应得 该物质与碳酸钠反应得 |
5.我国嫦娥五号探测器带回 的月球土壤,经分析发现其构成与地球土壤类似土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是
的月球土壤,经分析发现其构成与地球土壤类似土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是
 的月球土壤,经分析发现其构成与地球土壤类似土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是
的月球土壤,经分析发现其构成与地球土壤类似土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是A.原子半径大小顺序为 |
| B.化合物XW中的化学键为离子键 |
| C.Y单质的导电性能弱于Z单质的 |
| D.Z的氧化物的水化物的酸性强于碳酸 |
6.沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。

下列叙述错误的是

下列叙述错误的是
A.阳极发生将海水中的 氧化生成 氧化生成 的反应 的反应 |
B.管道中可以生成氧化灭杀附着生物的 |
C.阴极生成的 应及时通风稀释安全地排入大气 应及时通风稀释安全地排入大气 |
D.阳极表面形成的 等积垢需要定期清理 等积垢需要定期清理 |
7.HA是一元弱酸,难溶盐MA的饱和溶液中 随c(H+)而变化,
随c(H+)而变化, 不发生水解。实验发现,
不发生水解。实验发现, 时
时 为线性关系,如下图中实线所示。
为线性关系,如下图中实线所示。

下列叙述错误的是
 随c(H+)而变化,
随c(H+)而变化, 不发生水解。实验发现,
不发生水解。实验发现, 时
时 为线性关系,如下图中实线所示。
为线性关系,如下图中实线所示。
下列叙述错误的是
A.溶液 时, 时, |
B.MA的溶度积 |
C.溶液 时, 时, |
D.HA的电离常数 |
8.磁选后的炼铁高钛炉渣,主要成分有 、
、 、
、 、
、 、
、 以及少量的
以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的 见下表
见下表
回答下列问题:
(1)“焙烧”中, 、
、 几乎不发生反应,
几乎不发生反应, 、
、 、
、 、
、 转化为相应的硫酸盐,写出
转化为相应的硫酸盐,写出 转化为
转化为 的化学方程式
的化学方程式_______ 。
(2)“水浸”后“滤液”的 约为2.0,在“分步沉淀”时用氨水逐步调节
约为2.0,在“分步沉淀”时用氨水逐步调节 至11.6,依次析出的金属离子是
至11.6,依次析出的金属离子是_______ 。
(3)“母液①"中 浓度为
浓度为_______  。
。
(4)“水浸渣”在160℃“酸溶”最适合的酸是_______ 。“酸溶渣”的成分是_______ 、_______ 。
(5)“酸溶”后,将溶液适当稀释并加热, 水解析出
水解析出 沉淀,该反应的离子方程式是
沉淀,该反应的离子方程式是_______ 。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_______ ,循环利用。
 、
、 、
、 、
、 、
、 以及少量的
以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的
 见下表
见下表| 金属离子 |  |  |  |  |
开始沉淀的 | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全 的 的 | 3.2 | 4.7 | 11.1 | 13.8 |
(1)“焙烧”中,
 、
、 几乎不发生反应,
几乎不发生反应, 、
、 、
、 、
、 转化为相应的硫酸盐,写出
转化为相应的硫酸盐,写出 转化为
转化为 的化学方程式
的化学方程式(2)“水浸”后“滤液”的
 约为2.0,在“分步沉淀”时用氨水逐步调节
约为2.0,在“分步沉淀”时用氨水逐步调节 至11.6,依次析出的金属离子是
至11.6,依次析出的金属离子是(3)“母液①"中
 浓度为
浓度为 。
。(4)“水浸渣”在160℃“酸溶”最适合的酸是
(5)“酸溶”后,将溶液适当稀释并加热,
 水解析出
水解析出 沉淀,该反应的离子方程式是
沉淀,该反应的离子方程式是(6)将“母液①”和“母液②”混合,吸收尾气,经处理得
9.氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景,通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):

Ⅰ.将浓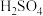 、
、 、石墨粉末在c中混合,置于冰水浴中,剧烈搅拌下,分批缓慢加入
、石墨粉末在c中混合,置于冰水浴中,剧烈搅拌下,分批缓慢加入 粉末,塞好瓶口。
粉末,塞好瓶口。
Ⅱ.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。
Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加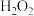 至悬浊液由紫色变为土黄色。
至悬浊液由紫色变为土黄色。
Ⅳ.离心分离,稀盐酸洗涤沉淀。
Ⅴ.蒸馏水洗涤沉淀。
Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)装置图中,仪器a、c的名称分别是_______ 、_______ ,仪器b的进水口是_______ (填字母)。
(2)步骤Ⅰ中,需分批缓慢加入 粉末并使用冰水浴,原因是
粉末并使用冰水浴,原因是_______ 。
(3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是_______ 。
(4)步骤Ⅲ中,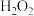 的作用是
的作用是_______ (以离子方程式表示)。
(5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在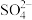 来判断。检测的方法是
来判断。检测的方法是_______ 。
(6)步骤Ⅴ可用 试纸检测来判断
试纸检测来判断 是否洗净,其理由是
是否洗净,其理由是_______ 。

Ⅰ.将浓
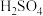 、
、 、石墨粉末在c中混合,置于冰水浴中,剧烈搅拌下,分批缓慢加入
、石墨粉末在c中混合,置于冰水浴中,剧烈搅拌下,分批缓慢加入 粉末,塞好瓶口。
粉末,塞好瓶口。Ⅱ.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。
Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加
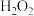 至悬浊液由紫色变为土黄色。
至悬浊液由紫色变为土黄色。Ⅳ.离心分离,稀盐酸洗涤沉淀。
Ⅴ.蒸馏水洗涤沉淀。
Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)装置图中,仪器a、c的名称分别是
(2)步骤Ⅰ中,需分批缓慢加入
 粉末并使用冰水浴,原因是
粉末并使用冰水浴,原因是(3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是
(4)步骤Ⅲ中,
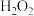 的作用是
的作用是(5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在
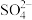 来判断。检测的方法是
来判断。检测的方法是(6)步骤Ⅴ可用
 试纸检测来判断
试纸检测来判断 是否洗净,其理由是
是否洗净,其理由是10.一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是ICl,从而错过了一种新元素的发现,该元素是_______ 。
(2)氯铂酸钡( )固体加热时部分分解为
)固体加热时部分分解为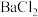 、
、 和
和 ,376.8℃时平衡常数
,376.8℃时平衡常数 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为 。376.8℃平衡时,测得烧瓶中压强为
。376.8℃平衡时,测得烧瓶中压强为 ,则
,则
_______  ,反应
,反应 的平衡常数K=
的平衡常数K=_______ (列出计算式即可)。
(3)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数 。
。


得到 和
和 均为线性关系,如下图所示:
均为线性关系,如下图所示:

①由图可知,NOCl分解为NO和 反应的
反应的
_______ 0(填“大于”或“小于”)
②反应 的K=
的K=_______ (用 、
、 表示):该反应的
表示):该反应的
_______ 0(填“大于”或“小于”),写出推理过程_______ 。
(4)Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率(v)光的照射下机理为:


其中 表示一个光子能量,
表示一个光子能量, 表示NOCl的激发态。可知,分解1mol的NOCl需要吸收
表示NOCl的激发态。可知,分解1mol的NOCl需要吸收_______ mol光子。
(1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是ICl,从而错过了一种新元素的发现,该元素是
(2)氯铂酸钡(
 )固体加热时部分分解为
)固体加热时部分分解为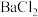 、
、 和
和 ,376.8℃时平衡常数
,376.8℃时平衡常数 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为 。376.8℃平衡时,测得烧瓶中压强为
。376.8℃平衡时,测得烧瓶中压强为 ,则
,则
 ,反应
,反应 的平衡常数K=
的平衡常数K=(3)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数
 。
。

得到
 和
和 均为线性关系,如下图所示:
均为线性关系,如下图所示:
①由图可知,NOCl分解为NO和
 反应的
反应的
②反应
 的K=
的K= 、
、 表示):该反应的
表示):该反应的
(4)Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率(v)光的照射下机理为:


其中
 表示一个光子能量,
表示一个光子能量, 表示NOCl的激发态。可知,分解1mol的NOCl需要吸收
表示NOCl的激发态。可知,分解1mol的NOCl需要吸收11.过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s轨道上电子能量较高,总是在比3s轨道上电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是_______ ,中心离子的配位数为_______ 。
(3) 中配体分子
中配体分子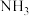 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。

 中P的杂化类型是
中P的杂化类型是_______ 。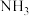 的沸点比
的沸点比 的
的_______ ,原因是_______ , 的键角小于
的键角小于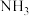 的,分析原因
的,分析原因_______ 。
(4)在金属材料中添加 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 具有体心四方结构,如图所示,处于顶角位置的是
具有体心四方结构,如图所示,处于顶角位置的是_______ 原子。设Cr和Al原子半径分别为 和
和 ,则金属原子空间占有率为
,则金属原子空间占有率为_______ %(列出计算表达式)。

 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s轨道上电子能量较高,总是在比3s轨道上电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(3)
 中配体分子
中配体分子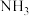 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
 中P的杂化类型是
中P的杂化类型是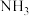 的沸点比
的沸点比 的
的 的键角小于
的键角小于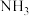 的,分析原因
的,分析原因(4)在金属材料中添加
 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 具有体心四方结构,如图所示,处于顶角位置的是
具有体心四方结构,如图所示,处于顶角位置的是 和
和 ,则金属原子空间占有率为
,则金属原子空间占有率为
12.卤沙唑仑W是一种抗失眠药物,在医药工业中的一种合成方法如下:

已知:(ⅰ)
(ⅱ)
回答下列问题:
(1)A的化学名称是_______ 。
(2)写出反应③的化学方程式_______ 。
(3)D具有的官能团名称是_______ 。(不考虑苯环)
(4)反应④中,Y的结构简式为_______ 。
(5)反应⑤的反应类型是_______ 。
(6)C的同分异构体中,含有苯环并能发生银镜反应的化合物共有_______ 种。
(7)写出W的结构简式_______ 。

已知:(ⅰ)

(ⅱ)

回答下列问题:
(1)A的化学名称是
(2)写出反应③的化学方程式
(3)D具有的官能团名称是
(4)反应④中,Y的结构简式为
(5)反应⑤的反应类型是
(6)C的同分异构体中,含有苯环并能发生银镜反应的化合物共有
(7)写出W的结构简式
 搜索
搜索
 难度系数:0.65
难度系数:0.65  答案解析
答案解析
 有奖纠错
有奖纠错
