全一卷
1.下列含有共价键的盐是
| A.CaCl2 | B.H2SO4 | C.Ba(OH)2 | D.Na2CO3 |
2.蒸馏操作中需要用到的仪器是
A. | B. | C. | D. |
3.下列物质属于强电解质的是
| A.KOH | B.H3PO4 | C.SO3 | D.CH3CHO |
4.下列物质与俗名对应的是
| A.纯碱:NaHCO3 | B.硫铵:NH4HSO4 |
C.TNT: | D.氯仿:CCl4 |
5.下列表示正确的是
A.甲醛的电子式 | B.乙烯的球棍模型 |
C.2-甲基戊烷的键线式 | D.甲酸乙酯的结构简式CH3COOCH3 |
6.下列说法不正确 的是
A.联苯( )属于芳香烃,其一溴代物有2种 )属于芳香烃,其一溴代物有2种 |
| B.甲烷与氯气在光照下发生自由基型链反应 |
| C.沥青来自于石油经减压分馏后的剩余物质 |
| D.煤的气化产物中含有CO、H2和CH4等 |
7.下列说法正确的是
| A.14N2和15N2互为同位素 | B.间二甲苯和苯互为同系物 |
| C.Fe2C和Fe3C互为同素异形体 | D.乙醚和乙醇互为同分异构体 |
8.下列说法不正确 的是
| A.铁粉与氧化铝发生的铝热反应可用于焊接铁轨 |
| B.镁燃烧会发出耀眼的白光,可用于制造信号弹和焰火 |
| C.熟石膏与水混合成糊状后能很快凝固,常用于制作模型和医疗石膏绷带 |
| D.工业上可用氨水消除燃煤烟气中的二氧化硫 |
9.下列说法不正确 的是
| A.某些胶态金属氧化物分散于玻璃中可制造有色玻璃 |
| B.通常以海水提取粗食盐后的母液为原料制取溴 |
| C.生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐 |
| D.工业制备硝酸的主要设备为沸腾炉、接触室和吸收塔 |
10.关于反应8NH3+6NO2=7N2+12H2O,下列说法正确的是
| A.NH3中H元素被氧化 |
| B.NO2在反应过程中失去电子 |
| C.还原剂与氧化剂的物质的量之比为3:4 |
| D.氧化产物与还原产物的质量之比为4:3 |
11.下列说法不正确 的是
| A.用纸层析法分离Fe3+和Cu2+,将滤纸上的试样点完全浸入展开剂可提高分离效果 |
| B.将CoCl2·6H2O晶体溶于95%乙醇,加水稀释,溶液颜色由蓝色逐渐转变为粉红色 |
| C.乙酰水杨酸粗产品中加入足量碳酸氢钠溶液,充分反应后过滤,可除去聚合物杂质 |
| D.某些强氧化剂(如:氯酸钾、高锰酸钾)及其混合物不能研磨,否则可能引起爆炸 |
12.下列“类比”合理的是
| A.Na与H2O反应生成NaOH和H2,则Fe与H2O反应生成Fe(OH)3和H2 |
| B.NaClO溶液与CO2反应生成NaHCO3和HClO,则NaClO溶液与SO2反应生成NaHSO3和HClO |
| C.Na3N与盐酸反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4Cl |
| D.NaOH溶液与少量AgNO3溶液反应生成Ag2O和NaNO3,则氨水与少量AgNO3溶液反应生成Ag2O和NH4NO3 |
13.下列反应的方程式不正确 的是
A.石灰石与醋酸反应:CO +2CH3COOH=2CH3COO- +CO2↑+H2O +2CH3COOH=2CH3COO- +CO2↑+H2O |
B.铜片上电镀银的总反应(银作阳极,硝酸银溶液作电镀液):Ag(阳极) Ag(阴极) Ag(阴极) |
C.铜与稀硝酸反应:3Cu+2NO +8H+=3Cu2+ +2NO↑+4H2O +8H+=3Cu2+ +2NO↑+4H2O |
D.明矾溶液中加入少量氢氧化钡溶液:2Al3+ +3SO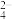 + 3Ba2++6OH-=2Al(OH)3↓+ 3BaSO4↓ + 3Ba2++6OH-=2Al(OH)3↓+ 3BaSO4↓ |
14.下列说法不正确 的是
| A.甘氨酸和丙氨酸混合,在一定条件下可生成4种二肽 |
| B.乙酸、苯甲酸、乙二酸(草酸)均不能使酸性高锰酸钾溶液褪色 |
| C.纤维素与乙酸酐作用生成的醋酸纤维可用于生产电影胶片片基 |
| D.工业上通常用植物油与氢气反应生产人造奶油 |
15.
有关  的说法
的说法
| A.分子中至少有12个原子共平面 |
| B.完全水解后所得有机物分子中手性碳原子数目为1个 |
| C.与FeCl3溶液作用显紫色 |
| D.与足量NaOH溶液完全反应后生成的钠盐只有1种 |
16.现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大,其中Z、Q在同一周期。相关信息如下表:
下列说法正确的是
| 元素 | 相关信息 |
| X | 最外层电子数是核外电子总数的一半 |
| Y | 最高化合价和最低化合价之和为零 |
| Z | 单质为淡黃色固体,常存在于火山喷口附近 |
| Q | 同周期元素中原子半径最小 |
下列说法正确的是
| A.常温时,X单质能与水发生剧烈反应 |
| B.Y与Q元素组成的YQ4分子,空间构型为正四面体 |
| C.Y、Z、Q最高价氧化物对应水化物的酸性依次减弱 |
| D.第五周期且与Q同主族元素的单质在常温常压下呈液态 |
17.25℃时,下列说法正确的是
| A.NaHA溶液呈酸性,可以推测H2A为强酸 |
| B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐 |
| C.0.010 mol·L-1、0.10mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2 |
| D.100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5mol |
18.设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1 mol NH4F晶体中含有的共价键数目为3NA |
| B.CH4和C2H4混合气体2.24L(标准状况)完全燃烧,则消耗O2分子数目为0.25NA |
| C.向100mL 0.10mol·L-1FeCl3溶液中加入足量Cu粉充分反应,转移电子数目为0.01NA |
| D.0.1 mol CH3COOH与足量CH3CH2OH充分反应生成的CH3COOCH2CH3分子数目为0.1NA |
19.取50 mL过氧化氢水溶液,在少量I- 存在下分解:2H2O2=2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:
下列说法不正确的是
| t/min | 0 | 20 | 40 | 60 | 80 |
| c/(mol·L-1) | 0.80 | 0.40 | 0.20 | 0.10 | 0.050 |
| A.反应20min时,测得O2体积为224mL(标准状况) |
| B.20~40min,消耗H2O2的平均速率为0.010mol·L-1·min-1 |
| C.第30min时的瞬时速率小于第50min时的瞬时速率 |
| D.H2O2分解酶或Fe2O3代替I-也可以催化H2O2分解 |
20.已知共价键的键能与热化学方程式信息如下表:
则2O(g)=O2(g)的ΔH为
| 共价键 | H- H | H-O |
| 键能/(kJ·mol-1) | 436 | 463 |
| 热化学方程式 | 2H2(g) + O2 (g)=2H2O(g) ΔH= -482kJ·mol-1 | |
| A.428 kJ·mol-1 | B.-428 kJ·mol-1 | C.498 kJ·mol-1 | D.-498 kJ·mol-1 |
21.铝硅酸盐型分子筛中有许多笼状空穴和通道(如图),其骨架的基本结构单元是硅氧四面体和铝氧四面体,化学组成可表示为Ma[(AlO2)x·(SiO2)y]·zH2O(M代表金属离子)。

下列推测不正确 的是

下列推测
| A.常采用水玻璃、偏铝酸钠在强酸溶液中反应后结晶制得分子筛 |
| B.若a=x/2,则M为二价阳离子 |
| C.调节y/x(硅铝比)的值,可以改变分子筛骨架的热稳定性 |
| D.分子筛中的笼状空穴和通道,可用于筛分分子 |
22.镍镉电池是二次电池,其工作原理示意图如下(L 为小灯泡,K1、K2为开关,a、b为直流电源的两极)。

下列说法不正确 的是

下列说法
| A.断开K2、合上K1,镍镉电池能量转化形式:化学能→电能 |
| B.断开K1、合上K2,电极A为阴极,发生还原反应 |
| C.电极B发生氧化反应过程中,溶液中KOH浓度不变 |
D.镍镉二次电池的总反应式:Cd+ 2NiOOH+2H2O Cd(OH)2+2Ni(OH)2 Cd(OH)2+2Ni(OH)2 |
23.实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法不正确 的是


| A.图中 |
B.将NH4Cl溶液加水稀释至浓度 mol·L-1,溶液pH变化值小于lgx mol·L-1,溶液pH变化值小于lgx |
| C.随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 |
D.25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH ) ) |
24.在298.15 K、100 kPa条件下,N2(g) +3H2 (g)=2NH3(g) ΔH=-92.4 kJ·mol-1,N2 (g) 、H2(g)和NH3(g)的比热容分别为29.1、28.9和35.6J·K-1·mol-1。一定压强下,1 mol反应中,反应物[N2(g) +3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是
A. | B. |
C. | D. |
25.下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验某无色溶液中是否含有NO | 取少量该溶液于试管中,加稀盐酸酸化,再加入FeCl2溶液 | 若溶液变黄色且试管上部产生红棕色气体,则该溶液中含有NO |
| B | 探究KI与FeCl3反应的限度 | 取5 mL 0.1 mol·L-1KI溶液于试管中,加入1 mL 0.1 mol·L-1 FeCl3溶液,充分反应后滴入5滴15% KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
| C | 判断某卤代烃中的卤素 | 取2 mL卤代烃样品于试管中,加入5 mL 20% KOH水溶液混合后加热,再滴加AgNO3溶液 | 若产生的沉淀为白色,则该卤代烃中含有氯元素 |
| D | 探究蔗糖在酸性水溶液中的稳定性 | 取2mL20%的蔗糖溶液于试管中,加入适量稀 H2SO4后水浴加热5 min;再加入适量新制Cu(OH)2悬浊液并加热 | 若没有生成砖红色沉淀 ,则蔗糖在酸性水溶液中稳定 |
| A.A | B.B | C.C | D.D |
26.(1)用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是______ 。
(2)金属镓(Ga)位于元素周期表中第4周期IIIA族,其卤化物的熔点如下表:
GaF3熔点比GaCl3熔点高很多的原因是______ 。
(2)金属镓(Ga)位于元素周期表中第4周期IIIA族,其卤化物的熔点如下表:
| GaF3 | GaCl3 | GaBr3 | |
| 熔点/℃ | > 1000 | 77. 75 | 122. 3 |
GaF3熔点比GaCl3熔点高很多的原因是
27.玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:
3S+6KOH 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
K2Sx(x=2~6)
S+ K2SO3 K2S2O3
K2S2O3
请计算:
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=______ 。
(2)2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=______ 。(写出计算过程)
3S+6KOH
 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O(x-1)S+K2S
 K2Sx(x=2~6)
K2Sx(x=2~6)S+ K2SO3
 K2S2O3
K2S2O3请计算:
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=
(2)2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=
28.某兴趣小组对化合物X开展探究实验。

其中:X是易溶于水的强酸盐,由3种元素组成;A和B均为纯净物;B可使品红水溶液褪色。请回答:
(1)组成X的3种元素是______ (填元素符号),X的化学式是______ 。
(2)将固体X加入温热的稀H2SO4中,产生气体B,该反应的离子方程式是______ 。
(3)步骤I,发生反应的化学方程式是______ 。
(4)步骤II,某同学未加H2O2溶液,发现也会缓慢出现白色浑浊,原因是______ 。
(5)关于气体B使品红水溶液褪色的原因,一般认为:B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明______ 。

其中:X是易溶于水的强酸盐,由3种元素组成;A和B均为纯净物;B可使品红水溶液褪色。请回答:
(1)组成X的3种元素是
(2)将固体X加入温热的稀H2SO4中,产生气体B,该反应的离子方程式是
(3)步骤I,发生反应的化学方程式是
(4)步骤II,某同学未加H2O2溶液,发现也会缓慢出现白色浑浊,原因是
(5)关于气体B使品红水溶液褪色的原因,一般认为:B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明
29.“氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:
(1)电解饱和食盐水制取氯气的化学方程式是______ 。
(2)下列说法不正确 的是______ 。
A.可采用碱石灰干燥氯气
B.可通过排饱和食盐水法收集氯气
C.常温下,可通过加压使氯气液化而储存于钢瓶中
D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl 2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1______ 0。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=______ 。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=______ 。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为;
I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1,KI=3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1,KII=1.2×1048
结合数据说明 氯化过程中加碳的理由______ 。
(5)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1,反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是______ 。
A.适当提高反应温度 B.改变催化剂
C.适当降低反应温度 D.改变反应物浓度
(1)电解饱和食盐水制取氯气的化学方程式是
(2)下列说法
A.可采用碱石灰干燥氯气
B.可通过排饱和食盐水法收集氯气
C.常温下,可通过加压使氯气液化而储存于钢瓶中
D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl 2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1
②平衡常数K2的表达式为K2=
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=
(4)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为;
I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1,KI=3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1,KII=1.2×1048
(5)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1,反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是
A.适当提高反应温度 B.改变催化剂
C.适当降低反应温度 D.改变反应物浓度
30.某兴趣小组用铬铁矿[Fe(CrO2)2]制备K2Cr2O7晶体,流程如下:

已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO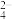
 Cr2O
Cr2O +H2O
+H2O
相关物质的溶解度随温度变化如下图。

请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是______ 。
(2)下列说法正确的是______ 。
A.步骤II,低温可提高浸取率
B.步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →______ →______ →______ →______ →重结晶。
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
①下列关于滴定分析的操作,不正确的是______ 。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,______ 继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是______ ,添加该试剂的理由是______ 。

已知:4Fe (CrO2)2 + 10Na2CO3+7O2
 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO22H++2CrO
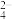
 Cr2O
Cr2O +H2O
+H2O相关物质的溶解度随温度变化如下图。

请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是
(2)下列说法正确的是
A.步骤II,低温可提高浸取率
B.步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
①下列关于滴定分析的操作,不正确的是
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是
31.某课题组合成了一种非天然氨基酸X,合成路线如下(Ph—表示苯基):

已知:R1—CH=CH—R2

R3Br R3MgBr
R3MgBr
请回答:
(1)下列说法正确的是______ 。
A.化合物B的分子结构中含有亚甲基和次甲基
B.1H-NMR谱显示化合物F中有2种不同化学环境的氢原子
C.G→H的反应类型是取代反应
D.化合物X的分子式是C13H15NO2
(2)化合物A的结构简式是______ ;化合物E的结构简式是______ 。
(3)C→D的化学方程式是______ 。
(4)写出3种同时符合下列条件的化合物H的同分异构体的结构简式(不包括立体异构体)______ 。
①包含 ;
;
②包含 (双键两端的C不再连接H)片段;
(双键两端的C不再连接H)片段;
③除②中片段外只含有1个-CH2-
(5)以化合物F、溴苯和甲醛为原料,设计下图所示化合物的合成路线(用流程图表示,无机试剂、有机溶剂任选)______ 。
 (也可表示为
(也可表示为 )
)

已知:R1—CH=CH—R2


R3Br
 R3MgBr
R3MgBr
请回答:
(1)下列说法正确的是
A.化合物B的分子结构中含有亚甲基和次甲基
B.1H-NMR谱显示化合物F中有2种不同化学环境的氢原子
C.G→H的反应类型是取代反应
D.化合物X的分子式是C13H15NO2
(2)化合物A的结构简式是
(3)C→D的化学方程式是
(4)写出3种同时符合下列条件的化合物H的同分异构体的结构简式(不包括立体异构体)
①包含
 ;
;②包含
 (双键两端的C不再连接H)片段;
(双键两端的C不再连接H)片段;③除②中片段外只含有1个-CH2-
(5)以化合物F、溴苯和甲醛为原料,设计下图所示化合物的合成路线(用流程图表示,无机试剂、有机溶剂任选)
 (也可表示为
(也可表示为 )
) 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
