全一卷
1.下列食品添加剂中,常用作防腐剂的是
| A.碘酸钾 | B.碳酸氢钠 | C.苯甲酸钠 | D.磷酸氢钠 |
2.某工业废气所含氮氧化物(NxOy)的氮氧质量比为7∶4,该NxOy可表示为
| A.N2O | B.NO | C.N2O3 | D.NO2 |
3.用浓硫酸配制稀硫酸时,不必要的个人安全防护用品是
| A.实验服 | B.橡胶手套 | C.护目镜 | D.防毒面罩 |
4.下列化合物中,能与Na2CO3溶液反应生成沉淀且沉淀可溶于NaOH溶液的是
| A.MgCl2 | B.Ca(NO3)2 | C.FeSO4 | D.AlCl3 |
5.化学与生产生活密切相关,下列说法错误的是
| A.Na2O2可与CO2反应放出氧气,可用于制作呼吸面具 |
| B.SiO2具有导电性,可用于制作光导纤维和光电池 |
| C.聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层 |
| D.氯水具有较强的氧化性,可用于漂白纸张.织物等 |
6.某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,下列说法正确的是
| A.AgCl的溶解度、Ksp均减小 | B.AgCl的溶解度、Ksp均不变 |
| C.AgCl的溶解度减小、Ksp不变 | D.AgCl的溶解度不变、Ksp减小 |
7.下列分离方法正确的是
| A.回收水溶液中的I2:加入乙酸,分液,蒸发 |
| B.回收含有KCl的MnO2:加水溶解,过滤,干燥 |
| C.除去氨气中的水蒸气:通过盛有P2O5的干燥管 |
| D.除去乙醇中的水,加入无水氯化钙,蒸馏 |
8.NA代表阿伏加德罗常数的值,下列说法正确的是
| A.12 g金刚石中含有化学键的数目为4NA |
| B.18 g的D2O中含有的质子数为10 |
| C.28 g的乙烯和环己烷混合气体中所含原子总数为6NA |
| D.1 L 1mol·L¯1的NH4Cl溶液中NH4+和Cl―的数目均为1NA |
9.实验室常用乙酸与过量的乙醇在浓硫酸催化下合成乙酸乙酯。下列说法正确的是
| A.该反应的类型为加成反应 |
| B.乙酸乙酯的同分异构体共有三种 |
| C.可用饱和的碳酸氢钠溶液鉴定体系中是否有未反应的乙酸 |
| D.该反应为可逆反应,加大乙醇的量可提高乙酸的转化率 |
10.一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是


| A.电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2 |
| B.正极反应式为:Mg-2e-=Mg2+ |
| C.活性炭可以加快O2在负极上的反应速率 |
| D.电子的移动方向由a经外电路到b |
11.絮凝剂有助于去除工业和生活废水中的悬浮物。下列物质可作为絮凝剂的是
| A.NaFe(SO4)2·6H2O | B.CaSO4·2H2O |
| C.Pb(CH3COO)2·3H2O | D.KAl(SO4)2·12H2O |
12.炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是


| A.每活化一个氧分子吸收0.29eV能量 |
| B.水可使氧分子活化反应的活化能降低0.42eV |
| C.氧分子的活化是O-O的断裂与C-O键的生成过程 |
| D.炭黑颗粒是大气中SO2转化为SO3的催化剂 |
13.X、Y、Z为短周期元素,X原子的质子数等于Z与Y的质子数之和;Z与Y位于同一周期,Y原子核外有3个未成对电子,非金属Z的一种固体单质可导电。回答下列问题:
(1)Y在周期表中的位置是第______ 周期第_____ 族,其原子结构示意图为_______________ ;Y与Z之间形成的化学键属于__________ 。
(2)X、Y、Z三种元素中原子半径最大的是__________ (填元素符号);X单质既可与盐酸反应,又可溶于氢氧化钠溶液,产生的气体为__________ (填分子式),该气体与Y单质反应的化学方程式为____________________________________ 。
(3)Z的最高价氧化物的电子式为____________________ 。
(1)Y在周期表中的位置是第
(2)X、Y、Z三种元素中原子半径最大的是
(3)Z的最高价氧化物的电子式为
14.铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为__________________ 。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式____________ 。配制的FeCl3溶液应保持_______ (填“酸性”“碱性”或“中性”),原因是_____________ 。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+ ②I3- +2
②I3- +2 =3I-+2
=3I-+2
反应①中的氧化剂为_____________ 。现取20.00 mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000 mol·L¯1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00 mL,此溶液中Cu2+的浓度为_______ mol·L¯1。
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+
 ②I3- +2
②I3- +2 =3I-+2
=3I-+2
反应①中的氧化剂为
15.二甲醚(CH3OCH3)是一种气体麻醉剂,可由“可燃冰”为原料合成。回答下列问题:

(1)B为黄绿色气体,其化学名称为____________ 。
(2)由A和B生成D的化学方程式为__________________ 。
(3)E的结构简式为____________ 。
(4)由E生成二甲醚的反应类型为______________________ 。
(5)二甲醚的同分异构体的结构简式为_____________ 。

(1)B为黄绿色气体,其化学名称为
(2)由A和B生成D的化学方程式为
(3)E的结构简式为
(4)由E生成二甲醚的反应类型为
(5)二甲醚的同分异构体的结构简式为
16.过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成.医疗消毒等领域。
回答下列问题:
(1)已知:H2(g)+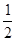 O2(g)=H2O(l) △H1=-286 kJ·mol¯1
O2(g)=H2O(l) △H1=-286 kJ·mol¯1
H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol¯1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=______ kJ·mol¯1。不同温度下过氧化氢分解反应的平衡常数K(313K)_____ K(298K) (填大于、小于或等于)。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______ 。贮运过氧化氢时,可选用的容器材质为_________ (填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
(3)过氧化氢的Ka1=2.24×10¯12,H2O2的酸性________ H2O (填大于、小于或等于)。
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是___________________ :相同pH下,过氧化氢浓度越大分解率越低的原因是__________________________________________ 。
回答下列问题:
(1)已知:H2(g)+
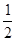 O2(g)=H2O(l) △H1=-286 kJ·mol¯1
O2(g)=H2O(l) △H1=-286 kJ·mol¯1H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol¯1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=
(2)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
| 离子 | 加入量(mg·L¯1) | 分解率% | 离子 | 加入量(mg·L¯1) | 分解率% |
| 无 | 0 | 2 | Fe3+ | 1.0 | 15 |
| Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
| Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
(3)过氧化氢的Ka1=2.24×10¯12,H2O2的酸性
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是

17.I.下列氯代烃中不能由烯烃与氯化氢加成直接得到的有__________
A.氯代环己烷 B.2,2-二甲基-1-氯丙烷
C.2-甲基-2-氯丙烷 D.2,2,3,3-四甲基-1-氯丁烷
II.盐酸美西律(E)是一种抗心律失常药,其一条合成路线如下:

回答下列问题:
(1)已知A的分子式为C8H10O,其化学名称为_______________ 。
(2)B中的官能团的名称为____________________ 。
(3)由A生成C的化学反应方程式为_________________________ ,反应类型是_______ 。
(4)由D的结构可判断,D应存在立体异构。该立体异构体的结构简式为________________ 。
(5)若用更为廉价易得的氨水替代盐酸羟氨(NH2OH·HCl)与C反应,生成物的结构简式为_____________________ 。
(6)A的同分异构体中能与三氯化铁溶液发生显色反应的还有_______ 种;其中核磁共振氢谱为4组峰,峰面积比为6︰2︰1︰1的结构简式为__________ 。
A.氯代环己烷 B.2,2-二甲基-1-氯丙烷
C.2-甲基-2-氯丙烷 D.2,2,3,3-四甲基-1-氯丁烷
II.盐酸美西律(E)是一种抗心律失常药,其一条合成路线如下:

回答下列问题:
(1)已知A的分子式为C8H10O,其化学名称为
(2)B中的官能团的名称为
(3)由A生成C的化学反应方程式为
(4)由D的结构可判断,D应存在立体异构。该立体异构体的结构简式为
(5)若用更为廉价易得的氨水替代盐酸羟氨(NH2OH·HCl)与C反应,生成物的结构简式为
(6)A的同分异构体中能与三氯化铁溶液发生显色反应的还有
18.
(1)I.下列元素或化合物的性质变化顺序正确的是_______________
A.第一电离能:Cl>S>P>Si B.共价键的极性:HF>HCI>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
II.黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(2)CuFeS2中存在的化学键类型是________________ 。下列基态原子或离子的价层电子排布图正确的_____________ 。

(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是______ ,中心原子杂化类型为__________ ,属于_______ (填“极性”或“非极性”)分子。
②X的沸点比水低的主要原因是____________________ 。
(4)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为_____ ,共价键的类型有_________ 。
(5)四方晶系CuFeS2晶胞结构如图所示。

①Cu+的配位数为__________ ,S2-的配位数为____________ 。
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________ g•cm-3(列出计算式)。
(1)I.下列元素或化合物的性质变化顺序正确的是_______________
A.第一电离能:Cl>S>P>Si B.共价键的极性:HF>HCI>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
II.黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(2)CuFeS2中存在的化学键类型是

(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是
②X的沸点比水低的主要原因是
(4)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为
(5)四方晶系CuFeS2晶胞结构如图所示。

①Cu+的配位数为
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是
19.某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题:

(1)选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。为了得到干燥.纯净的CO2,产生的气流应依次通过盛有_________ 的洗气瓶(填试剂名称)。反应结束后,关闭弹簧夹,可观察到的现象是____________________________ 。不能用稀硫酸代替稀盐酸,其原因是______________________________ 。
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。
据此推断,白色物质的主要成分是________ (填标号)。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是________________ 。
③本实验中金属钠与二氧化碳反应的化学方程式为_______________________ 。

(1)选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。为了得到干燥.纯净的CO2,产生的气流应依次通过盛有
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
| 步骤 | 现象 |
| 将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却 | 产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生 |
| 在集气瓶中加入适量蒸馏水,振荡.过滤 | 滤纸上留下黑色固体,滤液为无色溶液 |
据此推断,白色物质的主要成分是
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是
③本实验中金属钠与二氧化碳反应的化学方程式为
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
