全一卷
1.下列属于氧化物的是
| A.Na2O | B.Ca(OH)2 | C.HClO | D.K2CO3 |
2.下列仪器名称为“蒸馏烧瓶”的是
A. | B. | C. | D. |
3.下列属于电解质的是
| A.镁 | B.酒精 | C.硫酸铜 | D.食盐水 |
4.下列分散系属于悬浊液的是( )
| A.牛奶 | B.蔗糖溶液 | C.泥浆水 | D.氢氧化铁胶体 |
5.下列不属于化石燃料的是
| A.煤 | B.石油 | C.天然气 | D.甲醇 |
6.下列说法不正确 的是
| A.干冰可用于人工降雨 | B.碘酸钾可用作加碘食盐的添加剂 |
| C.碳酸钠是发酵粉的主要成分 | D.次氯酸钙是漂白粉的有效成分 |
7.下列属于置换反应的是
| A.2FeCl3+Cu=CuCl2+2FeCl2 | B.2HC1O  2HC1+O2↑ 2HC1+O2↑ |
C.CuO+CO Cu+CO2 Cu+CO2 | D.2Mg+CO2 2MgO+C 2MgO+C |
8.下列表示不正确的是
A.氯原子的结构示意图 | B.二氧化碳的结构式:O=C=O |
C.CH4的球棍模型 | D.乙醛的官能团 -CHO |
9.下列物质的水溶液不能使酚酞变红的是
| A.NaOH | B.Na2CO3 | C.NaCl | D.NH3 |
10.下列方法(必要时可加热)不合理的是
| A.用澄清石灰水鉴别CO和CO2 |
| B.用水鉴别苯和四氯化碳 |
| C.用Ba(OH)2溶液鉴别NH4Cl、(NH4)2SO4和K2SO4 |
| D.用淀粉碘化钾试纸鉴别碘水和溴水 |
11.下列说法正确的是
A. 表示中子数为10的氧元素的一种核素 表示中子数为10的氧元素的一种核素 |
| B.金刚石和石墨互为同素异形体,两者之间不能相互转化 |
| C.CH3COOH和CH3COOCH3互为同系物 |
| D.C6H14的同分异构体有4种,其熔点各不相同 |
12.下列离子方程式不正确的是
| A.氢氧化钠溶液与二氧化硅反应 SiO2 + 2OH-=SiO32- + H2O |
| B.碳酸钠溶液与氢氧化钡溶液反应 CO32-+ Ba(OH)2=BaCO3↓+2OH- |
| C.酸性硫酸亚铁溶液在空气中被氧化 4Fe2++O2+4H+=4Fe3++2H2O |
| D.氯气与氢氧化钠溶液反应 Cl2+ 2OH-=ClO- +Cl-+H2O |
13.Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是


| A.Y的原子半径比X的大 |
| B.Q的最高价氧化物的水化物的酸性比Z的强 |
| C.X、Y和氢3种元素形成的化合物中都只有共价键 |
| D.Q的单质具有半导体的性质,Q与Z可形成化合物QZ4 |
14.下列说法正确的是
| A.正丁烷和异丁烷均有两种一氯取代物 |
| B.乙烯和苯都能与H2发生加成反应,说明二者的分子中均含碳碳双键 |
| C.乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应更剧烈 |
| D.乙醛能被还原成乙醇,但不能被氧化成乙酸 |
15.下列说法正确的是
| A.花生油的主要成分是高级脂肪酸甘油酯,属于高分子化合物 |
| B.只有不同种类的氨基酸之间才能形成多肽 |
| C.向鸡蛋清的溶液中加入饱和硫酸钠溶液产生沉淀,加水后沉淀可溶解 |
| D.向淀粉溶液中加入硫酸溶液,加热后滴入几滴氢氧化铜悬浊液,再加热至沸腾,未出现红色物质,说明淀粉未水解 |
16.已知:N2(g)+3H2(g) 2NH3(g) △H=-92kJ/mol。起始反应物为
2NH3(g) △H=-92kJ/mol。起始反应物为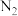 和
和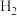 ,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中
,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中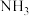 的物质的量分数如下表:
的物质的量分数如下表:
下列说法正确的是
 2NH3(g) △H=-92kJ/mol。起始反应物为
2NH3(g) △H=-92kJ/mol。起始反应物为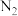 和
和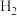 ,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中
,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中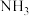 的物质的量分数如下表:
的物质的量分数如下表:| 温度 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
| 20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
| 30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A.体系中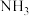 的物质的量分数越大,则正反应速率越大 的物质的量分数越大,则正反应速率越大 |
B.反应达到平衡时,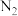 和 和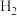 的转化率之比为1∶1 的转化率之比为1∶1 |
| C.反应达到平衡时,放出的热量均为92.4kJ |
D.600℃,30MPa下反应达到平衡时,生成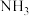 的物质的量最多 的物质的量最多 |
17.金属(M)-空气电池的工作原理如图所示。下列说法不正确 的是


| A.金属M作电池负极 |
| B.电解质是熔融的MO |
C.正极的电极反应 |
D.电池反应 |
18.下列说法不正确的是
| A.pH<7的溶液不一定呈酸性 |
| B.在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等 |
| C.在相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-)=c(CH3COO-) |
| D.氨水和盐酸反应后的溶液,若c(Cl―)=c(NH4+),则溶液呈中性 |
19.根据 体系的能量循环图:
体系的能量循环图:

下列说法正确的是:
 体系的能量循环图:
体系的能量循环图:
下列说法正确的是:
A. >0 >0 | B. |
C. | D. |
20.下列说法不正确的是
| A.Mg2+和S2―的最外层电子都形成了8个电子的稳定结构 |
| B.石英和金刚石都是原子间通过共价键结合形成的原子晶体 |
| C.浓H2SO4和H2O混合时放出热量与微粒之间的作用力有关 |
| D.H2O2易分解是因为H2O2分子间作用力弱 |
21.在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的关系如图所示(保持其他条件相同)。

在410~440℃温度范围内,下列说法不正确 的是

在410~440℃温度范围内,下列说法
| A.当乙醇进料量一定,随乙醇转化率增大,乙烯选择性升高 |
| B.当乙醇进料量一定,随温度的升高,乙烯选择性不一定增大 |
| C.当温度一定,随乙醇进料量增大,乙醇转化率减小 |
| D.当温度一定,随乙醇进料量增大,乙烯选择性增大 |
22.设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.含0.2 mol H2SO4的浓硫酸和足量的镁反应,转移电子数大于0.2 NA |
| B.25 ℃时,pH=3的醋酸溶液1L,溶液中含H+的数目小于0.001 NA |
| C.任意条件下,1 mol苯中含有C—H键的数目一定为6 NA |
| D.a mol 的R2+(R的核内中子数为N,质量数为A)的核外电子数为a(A-N-2)NA |
23.25℃时,在“H2A―HA-―A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是


| A.在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,α(HA-)一定增大 |
| B.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-) |
| C.NaHA溶液中,HA-的水解能力小于HA-的电离能力 |
| D.在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等 |
24.某兴趣小组查阅资料得知,连苯三酚的碱性溶液能定量吸收O2;CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液逐一吸收混合气体(由CO2、CO、N2和O2组成)的相应组分。有关该方案设计,下列说法不正确的是
| A.采用上述3种吸收剂,气体被逐一被吸收的顺序应该是CO2、O2和CO |
| B.其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代 |
| C.CO 的吸收必须在吸收O2后进行,因为CuCl的盐酸溶液会被O2氧化 |
| D.在3种气体被逐一吸收后,导出的气体中可能含有HCl |
25.取某固体样品,进行如下实验
①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取少量滤液,加入BaCl2溶液,有白色沉淀产生;
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是
①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取少量滤液,加入BaCl2溶液,有白色沉淀产生;
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是
| A.K2SO4、Ba(OH)2、Na2CO3 | B.Na2CO3、AgNO3、KNO3 |
| C.K2CO3、NaCl、Ba(NO3)2 | D.KNO3、MgCl2、NaOH |
26.A与CO、H2O以物质的量1︰1︰1的比例形成B,B中的两个官能团分别具有乙烯和乙酸中官能团的性质,E是有芳香气味、不易溶于水的油状液体,其转化关系如下:请回答:

(1)A的结构简式_____________________________ 。
(2)D→E的反应类型__________________________ 。
(3)C→E的化学方程式______________ 。
(4)下列说法不正确的是_______________________ 。
A.可用金属钠鉴别B和C
B.A在一定条件下可与氯化氢发生加成反应
C.乙酸和乙醇在浓硫酸作用下加热也可生成E
D.与A的最简式相同、相对分子质量为78的烃一定不能使酸性KMnO4溶液褪色

(1)A的结构简式
(2)D→E的反应类型
(3)C→E的化学方程式
(4)下列说法不正确的是
A.可用金属钠鉴别B和C
B.A在一定条件下可与氯化氢发生加成反应
C.乙酸和乙醇在浓硫酸作用下加热也可生成E
D.与A的最简式相同、相对分子质量为78的烃一定不能使酸性KMnO4溶液褪色
27.某研究小组按下列路线合成药物胃复安:

已知: ;
;
请回答:
(1)化合物A的结构简式__________________________ 。
(2)下列说法不正确的是__________________________ 。
A.化合物B能发生加成反应 B.化合物D能与FeCl3溶液发生显色反应
C.化合物E具有碱性 D.胃复安的分子式是C13H22ClN3O2
(3)设计化合物C经两步反应转变为D的合成路线(用流程图表示,试剂任选)_ 。
(4)写出D+E→F的化学方程式_____________________________ 。
(5)写出化合物E可能的同分异构体的结构简式__________________________ ,须同时符合:①1H-NMR谱表明分子中有3种氢原子,IR谱显示有N-H键存在;②分子中没有同一个碳上连两个氮( )的结构。
)的结构。

已知:
 ;
;
请回答:
(1)化合物A的结构简式
(2)下列说法不正确的是
A.化合物B能发生加成反应 B.化合物D能与FeCl3溶液发生显色反应
C.化合物E具有碱性 D.胃复安的分子式是C13H22ClN3O2
(3)设计化合物C经两步反应转变为D的合成路线(用流程图表示,试剂任选)
(4)写出D+E→F的化学方程式
(5)写出化合物E可能的同分异构体的结构简式
 )的结构。
)的结构。28.已知固体Na2SO3受热易分解,实验流程和结果如下:

已知:气体Y是一种纯净物,在标准状况下的密度为1.518g·L-1。请回答:
(1)气体Y分子的电子式_________________ ,白色沉淀的化学式___________________ 。
(2)该流程中的Na2SO3受热分解的化学方程式____________________________________ 。
(3)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生。写出产生淡黄色沉淀的离子方程式________________________ (不考虑空气的影响)。

已知:气体Y是一种纯净物,在标准状况下的密度为1.518g·L-1。请回答:
(1)气体Y分子的电子式
(2)该流程中的Na2SO3受热分解的化学方程式
(3)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生。写出产生淡黄色沉淀的离子方程式
29.为了探究铁、铜及其化合物的性质,某同学设计并进行了下列实验。

已知:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)。 请回答:
Fe3O4(s)+4H2(g)。 请回答:
(1)虚线框处宜选择的装置是_________ (填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是_______________ 。
(2)实验后,取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没有+3价的铁。判断结论是否正确并说明理由_______ 。

已知:3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g)。 请回答:
Fe3O4(s)+4H2(g)。 请回答:(1)虚线框处宜选择的装置是
(2)实验后,取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没有+3价的铁。判断结论是否正确并说明理由
30.某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
请回答:
(1)步骤Ⅰ中的化学方程式______________________________________ 。步骤Ⅱ中生成Al(OH)3的离子方程式________________________________________ 。
(2)步骤Ⅲ,下列操作合理的是______________________ 。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________ 。
①迅速降至室温 ②用玻璃棒摩擦器壁③配制90℃的明矾饱和溶液 ④自然冷却至室温
⑤选规则明矾小晶体并悬挂在溶液中央⑥配制高于室温10~20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如图:

①通入HCl的作用是抑制AlCl3水解和________________ 。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是____________________________ ;
洗涤时,合适的洗涤剂是______________________ 。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是___________________ 。

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
| 溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤Ⅰ中的化学方程式
(2)步骤Ⅲ,下列操作合理的是
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序
①迅速降至室温 ②用玻璃棒摩擦器壁③配制90℃的明矾饱和溶液 ④自然冷却至室温
⑤选规则明矾小晶体并悬挂在溶液中央⑥配制高于室温10~20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如图:

①通入HCl的作用是抑制AlCl3水解和
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是
洗涤时,合适的洗涤剂是
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是
31.取7.90gKMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+存在。
请计算:
(1)KMnO4的分解率_______________ 。
(2)气体A的物质的量_____________ 。
请计算:
(1)KMnO4的分解率
(2)气体A的物质的量
32.(一) 十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l) C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l) C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是_______________ 。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)研究表明,将适量十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是_____________________________________________________ 。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。


①在8 h时,反应体系内氢气的量为___________________ mol(忽略其他副反应)。
②x1显著低于x2的原因是____________________________ 。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图____ 。
(二) 科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。
阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:______________________________ 和2Fe+3H2O+N2=2NH3+Fe2O3。
C10H18(l)
 C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1C10H12(l)
 C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)研究表明,将适量十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。


①在8 h时,反应体系内氢气的量为
②x1显著低于x2的原因是
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图
(二) 科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。
阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
