全一卷
1.化学与生产和生活密切相关。下列过程中没有发生化学变化的是
| A.氯气作水杀菌消毒剂 |
| B.硅胶作袋装食品的干燥剂 |
| C.二氧化硫作纸浆的漂白剂 |
| D.肥皂水作蚊虫叮咬处的清洗剂 |
2.根据下列实验操作和现象得出的结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加KIO3 |
| D | 向苯酚钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
3.下列关于离子共存或离子反应的说法正确的是
| A.某无色溶液中可能大量存在H+、Cl-、MnO4- |
| B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32- |
| C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O |
| D.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
4.NA为阿伏伽德罗常数的值。下列说法正确的是
| A.2.4g镁在足量的O2中燃烧,转移的电子数为0.1NA |
| B.标准状况下,5.6 L CO2气体中含有的氧原子数为0.5NA |
| C.氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA |
| D.0.1 L 0.5 mol/L CH3COOH溶液中含有的H+数为0.05NA |
5.某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是
| A.放电时,Li+在电解质中由负极向正极迁移 |
| B.放电时,负极的电极反应式为LixC6-xe-= xLi++ C6 |
| C.充电时,若转移1 mol e-,石墨C6电极将增重7x g |
| D.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+ |
6.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始 =Z,在恒压下,平衡时
=Z,在恒压下,平衡时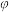 (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

 CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始 =Z,在恒压下,平衡时
=Z,在恒压下,平衡时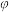 (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
| A.该反应的焓变ΔH>0 |
| B.图中Z的大小为a>3>b |
C.图中X点对应的平衡混合物中 =3 =3 |
D.温度不变时,图中X点对应的平衡在加压后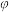 (CH4)减小 (CH4)减小 |
7.向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01 mol<n(CO2)  0.015时发生的反应是:
0.015时发生的反应是:
2 NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
 0.015时发生的反应是:
0.015时发生的反应是:2 NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
| 选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
| A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
| B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
| C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
| D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
8.M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
(1)R基态原子的电子排布式是 ① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
9.CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】

【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(1)仪器X的名称是__________。
(2)实验操作的先后顺序是a→______→e(填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_______。
(4)装置D中发生的氧化还原反应的离子方程式是________________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是________________。
②若杂质是CuO,则产生的原因是________________。
【资料查阅】

【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(1)仪器X的名称是__________。
(2)实验操作的先后顺序是a→______→e(填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_______。
(4)装置D中发生的氧化还原反应的离子方程式是________________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是________________。
②若杂质是CuO,则产生的原因是________________。
10.高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物。E的合成路线如下(部分反应条件和试剂略):

请回答下列问题:
(1)试剂Ⅰ的名称是______ ,试剂Ⅱ中官能团的名称是______ ,第② 步的反应类型是_______ 。
(2)第①步反应的化学方程式是_____________ 。
(3)第⑥步反应的化学方程式是_____________ 。
(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是_________ 。
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是___________ 。

请回答下列问题:
(1)试剂Ⅰ的名称是
(2)第①步反应的化学方程式是
(3)第⑥步反应的化学方程式是
(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是
11.资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________ 。
(2)实验室过滤所需的玻璃仪器是_____________ 。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________ 。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________ 。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________ 。
(6)在一定条件下CO(g)+H2O(g) CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________ kg。

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C
 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是
(2)实验室过滤所需的玻璃仪器是
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是
(6)在一定条件下CO(g)+H2O(g)
 CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
