全一卷
1.法国化学家拉瓦锡通过实验得出结论:约占空气总体积21%的气体是
| A.氮气 | B.氧气 | C.二氧化碳 | D.稀有气体 |
2.分类是学习化学的基本方法之一,下列物质属于氧化物的是
| A.SO2 | B.HCl | C.Cu | D.N2 |
3.下列图标或标志表示“禁止吸烟”的是
A. | B. | C. | D. |
4.下列现象一定含有化学变化的是
| A.水结成冰 | B.干冰升华 | C.酒精燃烧 | D.木材粉碎 |
5.对于二氧化碳的排放,我国提出力争于2030年前达到峰值,于2060年前实现碳中和。下列做法符合这一主题的是
| A.露天焚烧垃圾 |
| B.多开燃油汽车 |
| C.大量植树造林 |
| D.工厂废气直接排放 |
6.实验是学习化学的重要途径。下列实验操作中,不正确的是
A. 往试管送入粉末 往试管送入粉末 | B. 加热液体药品 加热液体药品 |
C. 熄灭酒精灯 熄灭酒精灯 | D. 读取液体体积 读取液体体积 |
7.“油、盐、酱、醋、糖”是家庭常用的厨房用品,其中与水充分混合不能形成溶液的是
| A.食用油 | B.食盐 | C.蔗糖 | D.米醋 |
8.因缺钙而导致骨质疏松、佝偻病等的患者需要服用补钙药品,其中“钙”指的是
| A.元素 | B.单质 | C.分子 | D.原子 |
9.“水稻之父”袁隆平院士致力于高产水稻的研究。为解决粮食需求问题立下卓越功勋。水稻中最主要的营养物质是
| A.脂肪 | B.糖类 | C.维生素 | D.无机盐 |
10.2021年4月,习总书记到柳州参观了螺蛳粉厂。我们在螺蛳粉厂区内能闻到特别的香味,用分子的观点解释该现象,正确的是
| A.分子由原子构成 | B.分子不可再分 |
| C.分子间有间隔 | D.分子在不断运动 |
11.下列常见物质的俗名与化学式相符的是
| A.水银—H2O2 |
| B.烧碱—NaOH |
| C.小苏打—NaCl |
| D.熟石灰—CaCO3 |
12.柳江是柳州的母亲河,2020年获得了全国地表水质量评比的第一名。 下列做法不利于保护柳江河的是
| A.工业废水处理后再排放 | B.合理使用农药化肥 |
| C.保护水生动物 | D.生活污水直接排进河流 |
13.模型认知是化学核心素养之一。下图是用来表示物质间发生化学反应的模型示意图,图中 分别表示C、O、H原子。下列说法正确的是
分别表示C、O、H原子。下列说法正确的是

 分别表示C、O、H原子。下列说法正确的是
分别表示C、O、H原子。下列说法正确的是
| A.CH3OH、CO2都属于有机物 |
| B.反应前后分子总数不变 |
| C.反应前后元素种类不变 |
| D.反应前后物质总质量发生改变 |
14.化学与生活息息相关,下列说法正确的是
| A.新冠疫情期间,可用75%的酒精消毒 |
| B.经常用湿布擦拭,可防止铁制品生锈 |
| C.用硫酸铜溶液浸泡粽子叶,美观营养 |
| D.在煤炉上放一壶水,可防止CO中毒 |
15.下列化学知识归纳完全正确的是
| 选项 | 内容 | 举例 |
| A | 化学常识 | (1)“绿色食品”指绿颜色的食物 (2)“白色污染”指白颜色垃圾造成的污染 |
| B | 俗语中的化学 | (1)钻木取火:使可燃物的着火点升高 (2)真金不怕火炼:描述的是金的物理性质 |
| C | 化学之最 | (1)地壳中含量最多的元素是氧元素 (2)最简单的有机物是甲烷 |
| D | 化学实验安全 | (1)点燃可燃性气体前不需要验纯 (2)鉴别化学药品可以品尝 |
| A.A | B.B | C.C | D.D |
16.配制一定浓度的氯化钠溶液时,需要称取12.5g氯化钠。在往托盘上的称量纸添加药品的过程中,天平的指针向左偏转,下列做法正确的是
| A.移动游码 | B.增加砝码 |
| C.移走部分药品 | D.继续添加药品 |
17.推理是化学思维的一种方式, 下列推理正确的是
| A.酸碱中和反应放出热量,所以放出热量的反应一定是酸碱中和反应 |
| B.催化剂在化学反应前后质量不变,所以反应前后质量不变的物质一定是催化剂 |
| C.置换反应有单质生成,所以有单质生成的反应一定是置换反应 |
| D.同种元素原子的质子数相同,所以质子数相同的原子一定属于同种元素 |
18.有元素化合价升降的反应属于氧化还原反应。下列流程中出现的反应属于氧化还原反应的是


| A.①② | B.②③ | C.②④ | D.③④ |
19.下列实验方案能达到实验目的是
| 选项 | 实验目的 | 实验方案 |
| A | 探究甲烷中含有碳元素 | 点燃甲烷,将干冷的烧杯罩在火焰上方, 观察是否有水珠生成 |
| B | 比较锌、铁、铜的金属活动性 | 将铜丝、铁丝分别浸入硫酸锌溶液中,观察溶液颜色的变化就能比较出三种金属活动性强弱 |
| C | 鉴别氯化钡、碳酸钾、硫酸钠、氢氧化钙四种溶液 | 将四种溶液两两混合就能鉴别 |
| D | 除去食盐水中混有的Ca2+、Mg2+、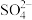 | 依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液,过滤,向滤液中滴加盐酸至中性 |
| A.A | B.B | C.C | D.D |
20.将8 g CuO 粉末加入到100 g一定质量分数的稀H2SO4溶液中,微热到CuO完全溶解,再向溶液中加入W g铁粉,使溶液中的溶质完全反应后过滤,将滤渣在低温下烘干,干燥后固体质量仍然为W g。下列分析不正确的是
| A.W可能是5.6 | B.W可能是6.4 |
| C.W可能是8 | D.W可能是12 |
21.用化学符号或名称填空。
(1)氧元素________ ;
(2)H+________ ;
(3)镁原子________ ;
(4)氯化钠________ ;
(5)CO________ ;
(6)OH-________ 。
(1)氧元素
(2)H+
(3)镁原子
(4)氯化钠
(5)CO
(6)OH-
22.在下列图片和各自意义的表述中,找到对应关系,在答题卡上用字母填空。

(1)
______ 。
(2)
______ 。
(3)
______ 。
(4)
______ 。
(5)
______ 。
(6)
______ 。

(1)

(2)

(3)

(4)

(5)

(6)

23.请在A~H八种物质中,选择符合题意的物质,用字母填空。
A. 金刚石B. 青铜C. 氢气 D. 氧气 E. 氧化铁 F. 酚酞G. 熟石灰 H. 聚四氟乙烯
(1)属于有机合成材料的是________________ ;
(2)可用来改良酸性土壤的是________________ ;
(3)赤铁矿的主要成分是________________ ;
(4)属于合金的是________________ ;
(5)能使带火星木条复燃的气体是________________ ;
(6)自然界中硬度最大的物质是________________ ;
(7)理想的清洁、高能燃料是________________ ;
(8)属于酸碱指示剂的是________________ 。
A. 金刚石B. 青铜C. 氢气 D. 氧气 E. 氧化铁 F. 酚酞G. 熟石灰 H. 聚四氟乙烯
(1)属于有机合成材料的是
(2)可用来改良酸性土壤的是
(3)赤铁矿的主要成分是
(4)属于合金的是
(5)能使带火星木条复燃的气体是
(6)自然界中硬度最大的物质是
(7)理想的清洁、高能燃料是
(8)属于酸碱指示剂的是
24.下表是硝酸钾、氯化钠在不同温度时的溶解度。
回答下列问题:
(1)10 ℃时,NaCl 的溶解度是________ g。
(2)由上表可知,________ (填“KNO3”或“NaCl”)的溶解度受温度变化的影响较大。
(3)20 ℃时,先加入7.5 g NaCl,再加入67.5 g水,搅拌至完全溶解,得到的NaCl溶液中溶质的质量分数为________ 。
(4)30 ℃时,为了验证KNO3不能无限溶解:向烧杯中加入100 g水,然后加入15.8 g KNO3,须再加入KNO3的质量为________________ 。
溶解度/g 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
回答下列问题:
(1)10 ℃时,NaCl 的溶解度是
(2)由上表可知,
(3)20 ℃时,先加入7.5 g NaCl,再加入67.5 g水,搅拌至完全溶解,得到的NaCl溶液中溶质的质量分数为
(4)30 ℃时,为了验证KNO3不能无限溶解:向烧杯中加入100 g水,然后加入15.8 g KNO3,须再加入KNO3的质量为
25.某学习小组进行探究性实验,先用铁和稀硫酸制备硫酸亚铁溶液,然后取少量硫酸亚铁溶液于试管中,滴入氢氧化钠溶液,有白色絮状沉淀Fe(OH)2生成,Fe(OH)2 在空气中不稳定,迅速转变成红褐色沉淀Fe(OH)3。
(1)请写出铁和稀硫酸反应的化学方程式____________________________ 。
(2)硫酸亚铁溶液与氢氧化钠溶液在空气中反应最终生成红褐色沉淀,写出反应的化学方程式________________________________ 。
(1)请写出铁和稀硫酸反应的化学方程式
(2)硫酸亚铁溶液与氢氧化钠溶液在空气中反应最终生成红褐色沉淀,写出反应的化学方程式
26.元素及其化合物是初中化学的基础知识。

(1)图1是硒元素的原子结构示意图及该元素在周期表中的部分信息,硒元素的原子序数是________ ,x的数值是________ 。
(2)图2是以化合价为纵坐标、物质的类别为横坐标所绘制的“价类图”。图中A~E是含氯元素的物质,每种物质中氯元素的化合价与纵坐标的数值对应。
盐酸是将上述物质________ (填字母, 从A~E中选填)溶于水得到的溶液; D物质的化学式是________ ;E 是“84”消毒液的主要成分,也可由HClO与NaOH反应生成,该反应的化学方程式是____________________________ 。
(3)ClO2和Cl2都可以用作自来水的杀菌消毒剂,它们的消毒原理是在高价态的氯元素变成Cl-的过程中杀死细菌。氯元素化合价变化数与杀菌消毒能力成正比,计算相同质量的ClO2杀菌消毒能力是Cl2的________ 倍。(精确到小数点后2位)

(1)图1是硒元素的原子结构示意图及该元素在周期表中的部分信息,硒元素的原子序数是
(2)图2是以化合价为纵坐标、物质的类别为横坐标所绘制的“价类图”。图中A~E是含氯元素的物质,每种物质中氯元素的化合价与纵坐标的数值对应。
盐酸是将上述物质
(3)ClO2和Cl2都可以用作自来水的杀菌消毒剂,它们的消毒原理是在高价态的氯元素变成Cl-的过程中杀死细菌。氯元素化合价变化数与杀菌消毒能力成正比,计算相同质量的ClO2杀菌消毒能力是Cl2的
27.为了充分利用资源、保护环境,柳州市大力推行垃圾分类投放。某校化学课外小组进行垃圾分类活动时,在垃圾处理厂发现一些铜锌合金材料(主要含Cu、 Zn), 查阅资料后,同学们设计利用此铜锌合金回收铜并制取ZnSO4的工艺流程如下图: (反应条件已略去)

(1)从垃圾分类的角度分析,金属材料属于________。
(2)金属活动性Zn___ Cu(填“>”或“<”)。加入稀硫酸之前须将合金粉碎,目的是___________ 。
(3)请写出步骤①溶解过程中Cu发生反应的化学方程式_____________________ 。
(4)“溶解池”中也可在酸性条件下通入过量氧气代替H2O2,与加入过量H2O2相比的优点是___________ 。
(5)步骤②中加入NaOH溶液的量不能太多,请说出原因:______________________________ 。

(1)从垃圾分类的角度分析,金属材料属于________。
| A.厨余垃圾 | B.可回收垃圾 | C.有害垃圾 | D.其他垃圾 |
(3)请写出步骤①溶解过程中Cu发生反应的化学方程式
(4)“溶解池”中也可在酸性条件下通入过量氧气代替H2O2,与加入过量H2O2相比的优点是
(5)步骤②中加入NaOH溶液的量不能太多,请说出原因:
28.化学是一门以实验为基础的学科。请结合下列实验装置图回答问题:

(1)写出仪器的名称:①________ ,②________ 。
(2)实验室用过氧化氢溶液制取氧气时,若要制取一瓶干燥的氧气, 必须使气体通过_____ (填字母,下同)装置,选用装置________ 收集。
(3)实验室用加热氯酸钾和二氧化锰固体混合物的方法制取氧气,检查该装置气密性的方法是:连接好仪器,把导管的一端浸入水中,__________________________________ ,证明装置连接完好、不漏气。写出该反应的化学方程式__________________________ 。
(4)实验室用电石固体与饱和食盐水在常温下反应制取乙炔(C2H2)气体,同时有糊状Ca(OH)2生成,发生装置选用C而不选用B的原因是___________________ ;将乙炔在一定量的氧气中燃烧,生成物为一氧化碳、二氧化碳、水,生成的水和一氧化碳的质量恰好相等,反应的化学方程式为________________ 。

(1)写出仪器的名称:①
(2)实验室用过氧化氢溶液制取氧气时,若要制取一瓶干燥的氧气, 必须使气体通过
(3)实验室用加热氯酸钾和二氧化锰固体混合物的方法制取氧气,检查该装置气密性的方法是:连接好仪器,把导管的一端浸入水中,
(4)实验室用电石固体与饱和食盐水在常温下反应制取乙炔(C2H2)气体,同时有糊状Ca(OH)2生成,发生装置选用C而不选用B的原因是
29.某兴趣小组的同学在整理化学实验室中酸类、碱类、盐类药品柜时,发现一瓶标签受损的溶液,他们决定对这瓶溶液的成分进行探究。
【提出问题】这瓶溶液的溶质是什么?
【猜想与假设】兴趣小组的同学根据这瓶溶液所存放的药品柜名称,提出猜想。

猜想一:该溶液属于酸类;
猜想二:该溶液属于碱类;
猜想三:该溶液属于盐类。
(1)小东同学认为从受损标签上还能读出的内容就可以确定猜想____ 错误,他的理由是________ 。
【设计实验】
【结论与反思】
(2)兴趣小组同学综合实验Ⅰ、Ⅱ的现象和结论,最终得出猜想________ 正确。
(3)写出实验Ⅱ中CO2使澄清石灰水变浑浊的化学方程式___________________ 。
(4)根据实验Ⅰ、Ⅱ的现象和结论,你确定这瓶溶液的溶质是________ 或者是________ 。仅限用实验Ⅰ、Ⅱ中药品及生成物,请你设计实验来确定这瓶溶液的溶质____________ 。
【探究启示】
(5)实验中倾倒液体药品时,应注意标签________________________ 。
【提出问题】这瓶溶液的溶质是什么?
【猜想与假设】兴趣小组的同学根据这瓶溶液所存放的药品柜名称,提出猜想。

猜想一:该溶液属于酸类;
猜想二:该溶液属于碱类;
猜想三:该溶液属于盐类。
(1)小东同学认为从受损标签上还能读出的内容就可以确定猜想
【设计实验】
| 实验序号 | 实验操作 | 实验现象 | 分析与结论 |
| 实验Ⅰ | 取一定量的该溶液,滴加酚酞 | 溶液变红 | 原溶液显碱性 |
| 实验Ⅱ | 取一定量的该溶液,加入稀盐酸充分反应,将产生的气体通入澄清石灰水中 | 澄清石灰水变浑浊 | 生成的气体是二氧化碳 |
【结论与反思】
(2)兴趣小组同学综合实验Ⅰ、Ⅱ的现象和结论,最终得出猜想
(3)写出实验Ⅱ中CO2使澄清石灰水变浑浊的化学方程式
(4)根据实验Ⅰ、Ⅱ的现象和结论,你确定这瓶溶液的溶质是
【探究启示】
(5)实验中倾倒液体药品时,应注意标签
30.小华为了测定鸡蛋壳中碳酸钙的含量,进行了如下实验:取50.0 g洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解,其它杂质不与盐酸反应),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。请回答下列问题:

(1)碳酸钙(CaCO3)由________ 元素组成,碳酸钙的相对分子质量为________ 。
(2)从图像可知鸡蛋壳中的碳酸钙恰好完全反应时,烧杯中剩余物质的质量为________ g,产生CO2的总质量为________ g。
(3)计算鸡蛋壳中碳酸钙的质量分数。(要求写出计算过程)

(1)碳酸钙(CaCO3)由
(2)从图像可知鸡蛋壳中的碳酸钙恰好完全反应时,烧杯中剩余物质的质量为
(3)计算鸡蛋壳中碳酸钙的质量分数。(要求写出计算过程)
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
