全一卷
1.今年我国环境日的主题是“共建清洁美丽世界”。下列做法中不符合这一主题的是
| A.分类处理生活垃圾 | B.直接排放生活污水 |
| C.使用可降解型塑料 | D.推广使用清洁能源 |
2.下列变化属于化学变化的是
| A.葡萄酿酒 | B.冰雪融化 | C.玻璃破碎 | D.酒精挥发 |
3.下列物质属于碱的是
| A.H2SO4 | B.SO2 | C.KNO3 | D.NaOH |
4.空气是一种宝贵的自然资源。其成分中,能供给人类呼吸的是
| A.二氧化碳 | B.稀有气体 | C.氧气 | D.氮气 |
5.规范的实验操作是实验成功的保证。下列实验操作错误的是
A.加入固体 | B.滴加溶液 |
C.读取体积 | D.加热溶液 |
6.如图为某天然饮用水标签的部分内容。根据标签信息,下列说法正确的是


| A.该饮用水是纯净物 | B.该饮用水一定呈酸性 |
| C.钙、镁、钠是指元素 | D.钾的质量分数为10% |
7.部分超导材料中含有钇元素。如图是钇元素的相关信息,下列关于钇的说法正确的是


| A.中子数为39 | B.属于非金属元素 | C.元素符号为Y | D.相对原子质量是88.91 g |
8.实验室常用酒精灯加热。下列说法错误的是
| A.酒精燃烧属于缓慢氧化反应 | B.用温度较高的外焰给物质加热 |
| C.用灯帽盖灭酒精灯的原理是隔绝氧气 | D.点燃酒精灯时温度需达到酒精的着火点 |
9.下列物质的性质和用途对应关系错误的是
| 选项 | 物质 | 性质 | 用途 |
| A | 铜 | 导电性 | 制导线 |
| B | 一氧化碳 | 可燃性 | 冶炼生铁 |
| C | 干冰 | 升华时吸热 | 人工降雨 |
| D | 熟石灰 | 碱性 | 改良酸性土壤 |
| A.A | B.B | C.C | D.D |
10.如图是自然界中碳、氧循环简图(X为H2CO3,Y为C6H12O6)。下列说法不正确的是


| A.图一中的转化1是酸雨形成的主要原因 |
| B.图二中可实现有机物与无机物的相互转化 |
| C.绿色植物通过光合作用,将太阳能转化成化学能 |
| D.碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定 |
11.我国古代制取黄铜的原理是: C+ ZnCO3+Cu2O 2CO2↑+ 2Cu+Zn。下列说法正确的是
2CO2↑+ 2Cu+Zn。下列说法正确的是
 2CO2↑+ 2Cu+Zn。下列说法正确的是
2CO2↑+ 2Cu+Zn。下列说法正确的是| A.黄铜的硬度比纯铜小 | B.反应中Cu2O发生氧化反应 |
| C.气体产物中可能含有CO | D.黄铜是锌、铜组成的复合材料 |
12.CO2资源化利用有利于实现碳中和。图是CO2与某种单质反应转化为甲醇的微观示意图。下列说法错误的是


| A.物质丙为有机化合物 | B.“ ”位于元素周期表第2周期 ”位于元素周期表第2周期 |
C.物质乙的微粒图示为“ ” ” | D.反应的甲和乙分子个数比为3:1 |
13.《抱朴子·金丹篇》记载:“丹砂(HgS)烧之成水银,积变又还成丹砂。”下列说法错误的是
| A.“水银”是指金属汞 | B.“烧之”说明该反应需要加热 |
| C.上述反应中可能有硫生成 | D.“积变又还成丹砂”是物理变化 |
14.下列化学反应方程式与描述相符,且书写完全正确的是
| A.用稀盐酸除铁锈:FeO+ 2HCl=FeCl2+H2O |
B.红磷在氧气中燃烧: P+O2 P2O5 P2O5 |
C.石灰石与二氧化硅高温反应: CaCO3+ SiO2 CaSiO3+ CO2↑ CaSiO3+ CO2↑ |
| D.工业上用电解法冶炼铝:2Al2O3=4Al+3O2 |
15.下列操作能够达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 除去氯化氢气体中的水蒸气 | 将混合气体通过氢氧化钠溶液 |
| B | 探究气态石蜡是否易燃 | 将尖嘴玻璃导管插入燃着的蜡烛烛心附近,在尖嘴处点燃 |
| C | 探究水对铁钉生锈的影响 | 将两枚洁净的铁钉分别放入装有蒸馏水和食盐水的两个小烧杯中 |
| D | 测定肥皂水的 pH | 用玻璃棒蘸取肥皂水滴到湿润的pH试纸上 |
| A.A | B.B | C.C | D.D |
16.海洋是人类宝贵的自然资源。下列说法错误的是
| A.海水淡化——利用物质的溶解度不同进行蒸馏分离 |
| B.海水晒盐——利用太阳能和风能蒸发水分得到粗盐 |
| C.海水制镁——利用碱将镁元素富集,提纯后电解 |
| D.海水“制碱”——利用氨碱法以食盐等原料制取纯碱 |
17.图中甲、乙、丙是三种常见的化合物,相连物质之间均能发生化学反应。下列符合图示要求的是


| A.若甲为CuO,乙、丙可以为H2SO4、H2 |
| B.若甲为HCl. 乙、丙可以为KOH、FeSO4 |
| C.若甲为NH4NO3,乙、 丙可以为HCl、Ca(OH)2 |
| D.若甲为Ba(OH)2, 乙、丙可以为CO2、Na2SO4 |
18.我国湿法炼铜的工艺在宋、元时期已相当成熟。小军同学在实验室模拟湿法炼铜,他取48.0g铁片放入一定质量的氯化铜溶液中,反应一段时间后, 得到50.0g固体。则所得固体中铁的质量分数为
| A.28.0% | B.68.0% | C.92.5% | D.96.0% |
19.请用化学用语填写下列空白,注意按示例要求书写大小写。示例:
(1)锂元素__________ ;
(2)2个氢离子__________ ;
(3)氧化镁__________ ;
(4)3个氮气分子__________ 。

(1)锂元素
(2)2个氢离子
(3)氧化镁
(4)3个氮气分子
20.“梧州纸包鸡”是用鸡肉块、香料、酱油、花生油等烹饪而成的一道名菜。2016年“纸包鸡制作技艺”项目入选广西非物质文化遗产名录。请回答:
(1)在远处闻到“纸包鸡”的香味,说明分子在_____________ 。
(2)鸡肉富含的营养物质有油脂、_____________ 。
(3)食用加铁酱油可预防缺铁性贫血,铁元素属于人体所需的____ (填“微量”或“常量”)元素。
(4)花生油属于油脂,在人体内可分解为脂肪酸和_____________ 。
(1)在远处闻到“纸包鸡”的香味,说明分子在
(2)鸡肉富含的营养物质有油脂、
(3)食用加铁酱油可预防缺铁性贫血,铁元素属于人体所需的
(4)花生油属于油脂,在人体内可分解为脂肪酸和
21.水是一种常见的溶剂,生活和化学实验活动中常用到水。请回答:
(1)电解水的实验说明水是由____ (填元素符号)组成的。
(2)自来水在输送过程中可能会二次污染,生活中需要__________ 后再饮用。
(3)KNO3的溶解度曲线如图所示。
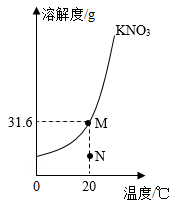
①20℃时,_____ 点 (填“M”或“N”)对应的溶液是饱和KNO3溶液。
②要从KNO3的饱和溶液中得到其晶体,一般采用______________ 结晶法。
(1)电解水的实验说明水是由
(2)自来水在输送过程中可能会二次污染,生活中需要
(3)KNO3的溶解度曲线如图所示。

①20℃时,
②要从KNO3的饱和溶液中得到其晶体,一般采用
22.近几年,我国在科学技术领域取得了举世瞩目的成就。
(1)①2022年北京冬奥会,国家速滑馆选用了二氧化碳跨临界制冷系统制冰。水结成冰的过程中,需要____ (填“吸收”或“放出”)能量。
②火炬“飞扬”采用高压储氢工艺贮存氢气,储氢过程中氢分子间的间隔________ (填“增大”或“减小”)。
(2)2022年6月5日,我国神州十四号载人飞船发射成功。
①在发射现场看到的大量红棕色的烟,是引燃后产生的一氧化氮气体遇到氧气反应生成的二氧化氮,该反应的化学方程式为________ 。
②空间站的太阳能板采用砷化镓材料,光电转化效率较高。砷元素(As)最外层电子数是5,砷化镓中镓(Ga)元素显+3价,该化合物的化学式为_________ 。
(3)嫦娥五号在月球上升起的五星红旗是由高性能芳纶纤[(C14H10O2N2)n]特制而成,芳纶纤维中碳元素与氮元素的质量最简比为________ 。
(1)①2022年北京冬奥会,国家速滑馆选用了二氧化碳跨临界制冷系统制冰。水结成冰的过程中,需要
②火炬“飞扬”采用高压储氢工艺贮存氢气,储氢过程中氢分子间的间隔
(2)2022年6月5日,我国神州十四号载人飞船发射成功。
①在发射现场看到的大量红棕色的烟,是引燃后产生的一氧化氮气体遇到氧气反应生成的二氧化氮,该反应的化学方程式为
②空间站的太阳能板采用砷化镓材料,光电转化效率较高。砷元素(As)最外层电子数是5,砷化镓中镓(Ga)元素显+3价,该化合物的化学式为
(3)嫦娥五号在月球上升起的五星红旗是由高性能芳纶纤[(C14H10O2N2)n]特制而成,芳纶纤维中碳元素与氮元素的质量最简比为
23.二氧化氯(ClO2)是一种常用的消毒剂,工业以粗盐水(含少量Ca2+、Mg2+、 等杂质离子)为原料生产ClO2,工艺流程如图8所示。
等杂质离子)为原料生产ClO2,工艺流程如图8所示。

(1)除去粗盐中的难溶性杂质的步骤是溶解、________ 。
(2)“精制”中,用下列药品除去杂质离子,请写出一组合理的添加顺序____ (填序号)。
①Na2CO3②BaCl2③NaOH
(3)“精制”最后应加入适量盐酸,其目的是除去溶液中的______ (填离子符号)。
(4)电解池中发生的主要化学反应方程式为_________________ 。
(5)生产过程中能循环利用的物质X是________ (填化学式)。
 等杂质离子)为原料生产ClO2,工艺流程如图8所示。
等杂质离子)为原料生产ClO2,工艺流程如图8所示。
(1)除去粗盐中的难溶性杂质的步骤是溶解、
(2)“精制”中,用下列药品除去杂质离子,请写出一组合理的添加顺序
①Na2CO3②BaCl2③NaOH
(3)“精制”最后应加入适量盐酸,其目的是除去溶液中的
(4)电解池中发生的主要化学反应方程式为
(5)生产过程中能循环利用的物质X是
24.结合下列实验装置,回答有关问题。
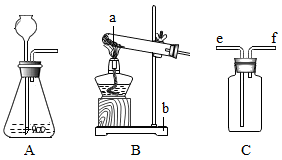
(1)写出图中对应仪器的名称:a___________ ,b______________ 。
(2)加热氯酸钾和二氧化锰可制备O2,应选择的气体发生装置是_______ (填字母)。
(3)实验室常用锌和稀硫酸反应制取氢气,该反应的化学方程式为_______________ ,若用装置C收集H2,气体应从____ (填“e”或“f”)端进入。

(1)写出图中对应仪器的名称:a
(2)加热氯酸钾和二氧化锰可制备O2,应选择的气体发生装置是
(3)实验室常用锌和稀硫酸反应制取氢气,该反应的化学方程式为
25.茶垢是茶中的有机物经过系列变化形成的,不易清洗。使用茶垢清洁剂可以轻松将茶垢除去。梧州某校化学兴趣小组对茶垢清洁剂的除垢原理、使用方法等进行了系列探究。
小吴按照说明书将适量茶垢清洁剂放入有茶垢的杯子中,加入热水浸没茶垢,立即产生大量气泡,一段时间后冲洗茶杯,茶杯光亮如新。
【提出问题1】产生的气体是什么?
【查阅资料】茶垢清洁剂的主要成分为过碳酸钠(Na2CO4)。
【猜想与假设】同学们对该气体的成分提出了三种猜想。
猜想1:只有O2;猜想2:__________ ;猜想3:既有O2又有CO2。

【实验验证】小吴按图装置对猜想进行如下验证:
【拓展实验】小周改用冷水重复上述实验,观察到锥形瓶中有持续的小气泡缓慢放出,带火星的木条没有复燃。该木条不复燃的原因是___________________ 。
【交流与讨论】老师提示,茶垢清洁剂是利用过碳酸钠与水反应产生具有强氧化性的活性氧,使茶垢分解、剥离、脱落。所以,使用茶垢清洁剂时,加入_________ 的水, 效果更好。
【提出问题2】过碳酸钠与热水反应后所得溶液E中溶质的成分是什么?
【猜想与假设】同学们查阅资料后,作出三种猜想。
猜想1:只有Na2CO3;
猜想2:只有NaOH;
猜想3:既有Na2CO3又有NaOH。
【实验验证】小施从下列试剂中选择合适的试剂完成探究:稀盐酸、饱和Ca(OH)2溶液、CaCl2溶液、酚酞溶液、Ba(OH)2溶液。
【交流与讨论】步骤2中选用CaCl2而不用Ca(OH)2的原因是________________ 。
【总结提升】
(1)根据过碳酸钠的性质,保存茶垢清洁剂应注意________________ 。
(2)过氧化钠(Na2O2)常用作供氧剂,其与水反应的历程与过碳酸钠类似,即先与水反应生成过氧化氢和一种碱,之后过氧化氢迅速分解。请写出过氧化钠与水反应的总反应方程式________________ 。
小吴按照说明书将适量茶垢清洁剂放入有茶垢的杯子中,加入热水浸没茶垢,立即产生大量气泡,一段时间后冲洗茶杯,茶杯光亮如新。
【提出问题1】产生的气体是什么?
【查阅资料】茶垢清洁剂的主要成分为过碳酸钠(Na2CO4)。
【猜想与假设】同学们对该气体的成分提出了三种猜想。
猜想1:只有O2;猜想2:

【实验验证】小吴按图装置对猜想进行如下验证:
| 操作 | 现象 | 结论 |
| 检查气密性后,向A中加入热水,将生成的气体依次通过B、C,向D中插入带火星的木条。 | 观察到B中 | 猜想1正确。 |
【拓展实验】小周改用冷水重复上述实验,观察到锥形瓶中有持续的小气泡缓慢放出,带火星的木条没有复燃。该木条不复燃的原因是
【交流与讨论】老师提示,茶垢清洁剂是利用过碳酸钠与水反应产生具有强氧化性的活性氧,使茶垢分解、剥离、脱落。所以,使用茶垢清洁剂时,加入
【提出问题2】过碳酸钠与热水反应后所得溶液E中溶质的成分是什么?
【猜想与假设】同学们查阅资料后,作出三种猜想。
猜想1:只有Na2CO3;
猜想2:只有NaOH;
猜想3:既有Na2CO3又有NaOH。
【实验验证】小施从下列试剂中选择合适的试剂完成探究:稀盐酸、饱和Ca(OH)2溶液、CaCl2溶液、酚酞溶液、Ba(OH)2溶液。
| 操作 | 现象 | 结论 |
| 步骤1:取少量溶液E,滴加 | 有气泡产生 | 溶液中一定有 Na2CO3,猜想2不正确。 |
| 步骤2:另取少量溶液E,滴加CaCl2溶液至不再产生沉淀为止,向上层清液中加入 | 无明显现象 | 溶液中无NaOH,猜想3不正确,猜想1正确。 |
【交流与讨论】步骤2中选用CaCl2而不用Ca(OH)2的原因是
【总结提升】
(1)根据过碳酸钠的性质,保存茶垢清洁剂应注意
(2)过氧化钠(Na2O2)常用作供氧剂,其与水反应的历程与过碳酸钠类似,即先与水反应生成过氧化氢和一种碱,之后过氧化氢迅速分解。请写出过氧化钠与水反应的总反应方程式
26.实验室用质量分数为20.0%的稀硫酸处理含Ba(OH)2的废液。向100.0g废液中加入稀硫酸至溶液恰好呈中性,最终得到2.33 g沉淀。请计算:
(1)配制490.0 g 20.0%的稀硫酸需质量分数为98.0%的浓硫酸____________ g。
(2)废液中Ba(OH)2的质量分数。
(1)配制490.0 g 20.0%的稀硫酸需质量分数为98.0%的浓硫酸
(2)废液中Ba(OH)2的质量分数。
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
