全一卷
1.2022年北京冬奥会在世界上首次采用CO2跨临界直冷制冰技术,其原理是将液态CO2蒸发吸热,使水变成冰实现制冷。其中CO2由液态转化为气态的过程中,从微观角度分析发生改变的是
| A.分子的种类 | B.分子间的间隔 |
| C.分子的质量 | D.分子的大小 |
2.阿司匹林是一种解热镇痛药,可治疗感冒、发热,还能抑制血小板聚集。其化学式为C9H8O4,下列有关阿司匹林说法正确的是
| A.一个阿司匹林分子由21个原子构成 |
| B.阿司匹林的相对分子质量为180g |
| C.阿司匹林中氧元素的质量分数最小 |
| D.阿司匹林中C、H、O三种元素的质量比为9:8:4 |
3.下列生产生活中的应用,利用了中和反应原理的是
| A.生石灰用作食品干燥剂 |
| B.用熟石灰和硫酸铜制波尔多液 |
| C.用小苏打做面点发酵剂 |
| D.服用含A1(OH)3的药物治疗胃酸过多 |
4.下列方法可达到实验目的的是
| A.用燃着的小木条鉴别N2和CO2 |
| B.用水鉴别CaCO3、NaOH、CuSO4三种固体 |
| C.用稀盐酸除去CaO中混有的CaCO3杂质 |
| D.用酚酞溶液鉴别稀硫酸和NaCl溶液 |
5.某同学绘制了含铁元素的部分物质转化关系图(图中“→”表示一种物质可以转化为另一种物质,部分反应物、生成物及反应条件已略去),下列说法正确的是


| A.铁丝能在空气中剧烈燃烧实现转化① |
| B.转化②可通过Fe3O4与CO发生置换反应实现 |
| C.氧气和水同时存在是实现转化③的主要条件 |
| D.通过Fe与ZnSO4溶液反应可实现转化④ |
6.下列四组实验均是向盛有不同物质的烧杯中逐滴加入X溶液至过量。生成沉淀或气体的质量与加入X溶液的质量关系,符合图像的一组是


| 组别 | 烧杯中的物质 | X溶液 |
| ① | CuSO4和Na2SO4溶液 | NaOH溶液 |
| ② | 铜锌合金 | 稀H2SO4 |
| ③ | 稀HNO3和稀H2SO4 | BaCl2溶液 |
| ④ | NaOH和Na2CO3溶液 | 稀盐酸 |
| A.① | B.② | C.③ | D.④ |
7.阅读短文,回答下列问题:
城市居民生活净水,主要靠自来水厂供给。在自来水厂里,水的净化过程主要包括:①絮凝(使悬浮物质自然凝结沉淀或加入明矾)②过滤③吸附(加活性炭)④杀菌【加入氯气(C12)、臭氧(O3)或二氧化氯(C1O2)等消毒剂】。经过这样处理所得的水,就是自来水。
上述水的净化过程中,②③④中属于化学变化的是______ (填序号):净化后得到的自来水属于______ (填“纯净物”或“混合物”):自来水来之不易,要爱惜和节约使用,请列举一条节约用水的做法______ 。
城市居民生活净水,主要靠自来水厂供给。在自来水厂里,水的净化过程主要包括:①絮凝(使悬浮物质自然凝结沉淀或加入明矾)②过滤③吸附(加活性炭)④杀菌【加入氯气(C12)、臭氧(O3)或二氧化氯(C1O2)等消毒剂】。经过这样处理所得的水,就是自来水。
上述水的净化过程中,②③④中属于化学变化的是
8.如图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
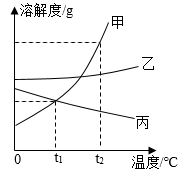
t1℃时甲、乙、丙溶解度最大的是______ ,将该温度时三种物质的饱和溶液升温到t2℃(不考虑溶剂蒸发),有固体析出的是______ ,此时所得溶液的溶质质量分数由大到小的顺序是______ 。

t1℃时甲、乙、丙溶解度最大的是
9.下图是实验室制取气体的常用装置,回答下列问题:
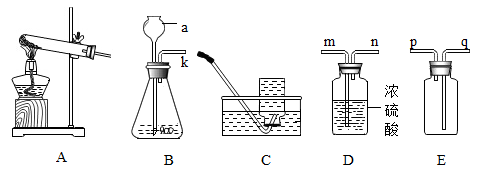
(1)仪器a的名称是______ 。
(2)实验室用氯酸钾和二氧化锰混合制取氧气,应选择的发生装置是______ (填序号),该反应的化学方程式为______ 。若用装置C收集氧气,刚开始有气泡产生时不宜立即收集,原因是______ 。
(3)若用装置B、D、E组合制取并收集一瓶干燥的二氧化碳,按气流方向,导管口的连接顺序为k→______ (填导管接口的字母)。

(1)仪器a的名称是
(2)实验室用氯酸钾和二氧化锰混合制取氧气,应选择的发生装置是
(3)若用装置B、D、E组合制取并收集一瓶干燥的二氧化碳,按气流方向,导管口的连接顺序为k→
10.以化合价为纵坐标,物质类别为横坐标,绘制的图像叫“价类二维图”。下图是碳元素的“价类二维图”,图中A、B、D、E分别表示不同的物质。回答下列问题:
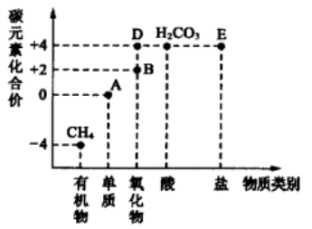
(1)A的单质有多种,写出其中一种的名称______ 。
(2)B、D可相互转化,B和______ (填化学式)在一定条件下反应能生成D。
(3)科学家将D进行转化实现资源化利用,其中一种方法是: ,X的化学式为
,X的化学式为______ 。
(4)D、E可相互转化,若E是由三种元素组成,写出D→E的一个化学方程式______ 。

(1)A的单质有多种,写出其中一种的名称
(2)B、D可相互转化,B和
(3)科学家将D进行转化实现资源化利用,其中一种方法是:
 ,X的化学式为
,X的化学式为(4)D、E可相互转化,若E是由三种元素组成,写出D→E的一个化学方程式
11.某食品包装袋中脱氧剂的成分可能含有铁粉、碳粉、碳酸钠、氯化钠、氧化铁中的几种,兴趣小组为确定其成分,进行如下实验。
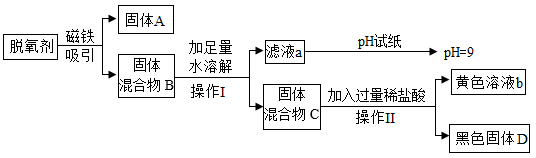
回答下列问题:
(1)固体A的化学式为______ 。
(2)操作I的名称是______ 。
(3)黄色溶液b中一定存在的阳离子是______ (填离子符号)。
(4)综合分析该脱氧剂中一定含有的成分是______ 。
(5)为验证该脱氧剂中还未确定的物质是否存在,应采用的实验方案是______ (写出实验操作、现象及结论)。

回答下列问题:
(1)固体A的化学式为
(2)操作I的名称是
(3)黄色溶液b中一定存在的阳离子是
(4)综合分析该脱氧剂中一定含有的成分是
(5)为验证该脱氧剂中还未确定的物质是否存在,应采用的实验方案是
12.常温下,向盛有100gNaOH溶液的烧杯中逐滴加入溶质质量分数为3.65%的稀盐酸,测得反应过程中溶液的pH与加入稀盐酸的质量数据如下:
(1)当溶液为中性时,消耗稀盐酸的质量为______ g。
(2)计算该NaOH溶液中溶质的质量分数。
(3)计算恰好完全反应时,所得溶液的溶质质量分数。
| 加入稀盐酸的质量/g | 80 | 100 | 120 |
| 烧杯中溶液的pH | 13.0 | 7.0 | 1.0 |
(1)当溶液为中性时,消耗稀盐酸的质量为
(2)计算该NaOH溶液中溶质的质量分数。
(3)计算恰好完全反应时,所得溶液的溶质质量分数。
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
