全一卷
1.下面哪个气体是稀有气体
| A.氦气 | B.氮气 | C.氯气 | D.氧气 |
2.以下酸性最强的是( )
| A.pH=1 | B.pH=3 | C.pH=5 | D.pH=7 |
3.用氯酸钾制取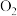 ,下列化学方程式正确的是
,下列化学方程式正确的是
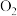 ,下列化学方程式正确的是
,下列化学方程式正确的是A. | B. |
C. | D. |
4.利用下图,欲除去X气体中的杂质,对应的Y正确的是


| X杂质 | Y | |
| A | CO2(CO) | Cu |
| B | N2(O2) | Cu |
| C | CO(H2) | CuO |
| D | H2(H2O) | CuO |
| A.A | B.B | C.C | D.D |
5.对于碱,下列说法正确的是
| A.碱一定含有 H 元素 | B.可使酚酞变红的都是碱溶液 |
| C.所有非金属氧化物都可与碱溶液反应 | D.酸与碱反应一定不产生沉淀 |
6.灼烧氯化钠,火焰呈____ 色。
7.Mg(OH)2是一种难溶的碱,可用MgCl2和NaOH反应制取Mg(OH)2,现用该方法制取纯净的Mg(OH)2。
(1)氢氧化钠的俗称___ ,两种物质在20℃的溶解度如下表所示,此时溶解度较小的物质是___ 。
(2)MgCl2和NaOH反应的化学方程式_______ ,生成物质质量如下图所示,则a为_______ 。

(3)按下表方法可否达成实验目的?_____ 结合数据分析,说明理由____ 。

(1)氢氧化钠的俗称
| 物质 | 溶解度(g/100g水) |
| NaOH | 109.0 |
| NaCl | 36.0 |

(3)按下表方法可否达成实验目的?

8.对于t℃时的30%KNO3溶液,下列说法正确的是
| A.均一、稳定、透明 | B.每100g水中溶解30gKNO3 |
| C.某种条件下,可转化为悬浊液 | D.若再加30g硝酸钾,则变为60%KNO3溶液 |
9.下列选项中,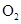 的物理量比
的物理量比 大的是
大的是
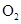 的物理量比
的物理量比 大的是
大的是A.一个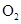 分子和一个 分子和一个 分子的质量 分子的质量 | B.1mol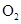 和1mol 和1mol 的质量 的质量 |
C.1g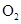 和1g 和1g 的分子数 的分子数 | D.1mol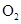 和1mol 和1mol 的分子数 的分子数 |
10.CO2是一种常见的物质,回答下列问题:
(1)木炭燃烧的化学方程式:_______ ;
(2)用启普发生器制CO2如图所示,在多孔塑料板上放着的块状固体为_______ ;所用HCl的量不宜太多,若液体在反应时,液面处于a处,则关闭弹簧夹时导致的后果是:_______ ;

(3)实验小组欲制取CaCO3,步骤如下图:

Ⅰ.步骤①的化学方程式:_______ ;
Ⅱ.需要加_______ 药品,理论上可以不断生成CaCO3,原因是:_______ ;
(1)木炭燃烧的化学方程式:
(2)用启普发生器制CO2如图所示,在多孔塑料板上放着的块状固体为

(3)实验小组欲制取CaCO3,步骤如下图:

Ⅰ.步骤①的化学方程式:
Ⅱ.需要加
11.某班级研究铁、铜、银的金属活动性,并回收Ag。
①判断铁、铜、银中金属活动性最强的是_______ ;
②Cu与AgNO3反应的化学方程式_______ ;Fe与Cu(NO3)2反应后,Fe 表面析出_______ 色固体;
③现有Fe(NO3)2、Cu(NO3)2、AgNO3混合废液,目的回收Ag:

ⅰ.滤液A的溶质是_______ ;步骤Ⅲ中加入足量AgNO3溶液的目的是_______ ;何确定滤液C中有AgNO3,应选_______ 溶液;
ⅱ.若将步骤Ⅰ中的amolCu改为amolFe,最终得到Ag的质量是否会改变,请说明理由:____ 。
①判断铁、铜、银中金属活动性最强的是
②Cu与AgNO3反应的化学方程式
③现有Fe(NO3)2、Cu(NO3)2、AgNO3混合废液,目的回收Ag:

ⅰ.滤液A的溶质是
ⅱ.若将步骤Ⅰ中的amolCu改为amolFe,最终得到Ag的质量是否会改变,请说明理由:
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
