全一卷
1.下列日常生活中的现象,没有发生化学变化的是
| A.光合作用 | B.滴水成冰 |
| C.牛奶酸败 | D.食醋酿造 |
2.下面对于过氧化氢(H2O2)组成的说法,正确的是
| A.过氧化氢由氢气和氧气组成 |
| B.过氧化氢由氢分子和氧分子构成 |
| C.过氧化氢由氢元素和氧元素组成 |
| D.过氧化氢由氢原子和氧原子构成 |
3.下列各组物质,都属于氧化物的一组是
| A.MnO2、SO2、P2O5 | B.ZnO、CO2、H2SO3 |
| C.Na2O、H2O、KC1O3 | D.SiO2、KOH、CH4O |
4.下列化学方程式的书写和对反应类型的判断,都正确的是
A. 化合反应 化合反应 |
B. 分解反应 分解反应 |
C. 置换反应 置换反应 |
D. 复分解反应 复分解反应 |
5.根据下面实验过程得出的结论,不正确的是
| 选项 | 实验过程 | 实验结论 |
| A | 红热的木炭放入盛有氧气的集气瓶中,剧烈燃烧发出白光 | 氧气浓度大,木炭燃烧剧烈 |
| B | 湿润的蓝色石蕊试纸放入盛有二氧化碳气体的集气瓶中,蓝色石蕊试纸变为红色 | 二氧化碳能与水反应生成碳酸 |
| C | 氢氧化钠固体置于空气中,表面很快变得潮湿并逐渐溶解 | 氢氧化钠固体有吸水性 |
| D | 向未知溶液中滴加氯化钡试液,有白色沉淀生成,再滴加稀硝酸,沉淀不消失 | 溶液中一定含有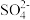 |
| A.A | B.B | C.C | D.D |
6.为探究硝酸钾的溶解性,进行了如图实验(见图Ⅰ),结合KNO3溶解度曲线(见图Ⅱ)判断,下列说法错误的是


| A.溶液②、溶液④一定是饱和溶液 |
| B.溶液①、溶液③一定是不饱和溶液 |
| C.溶液②、溶液③的质量:③>② |
| D.溶液②、溶液③溶液④的溶质质量分数:③>②=④ |
7.下列物质间的转化关系,不能实现的是
A. | B. |
C. | D. |
8.一定质量的M、N两种金属,分别与相同质量和相同质量分数的稀硫酸反应,生成氢气的质量与反应时间的关系如图所示,分析图象得到的以下结论中,不正确的是


| A.两种金属的活动性:M>N |
| B.两种金属生成氢气的质量:M=N |
| C.两种金属消耗稀硫酸的质量:M=N |
| D.充分反应后,得到溶液的质量:M=N |
9.下列四组物质的溶液,使用一种试剂仅通过一次反应就能将他们鉴别开来的是
| A.HCl、NaOH、Na2CO3 | B.NaCl、Na2CO3、NaNO3 |
| C.NaCl、BaCl2、K2CO3 | D.NaOH、BaCl2、 |
10.为确定某溶液中含有以下离子H+、Mg2+、Ba2+、C1-、 、
、 中的几种,进行了以下实验:
中的几种,进行了以下实验:
①经测定,溶液pH=1;
②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生;
③取②中部分溶液加入Na2CO3溶液,无明显现象。
分析上述实验,下面对溶液中含有离子的判断,正确的是
 、
、 中的几种,进行了以下实验:
中的几种,进行了以下实验:①经测定,溶液pH=1;
②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生;
③取②中部分溶液加入Na2CO3溶液,无明显现象。
分析上述实验,下面对溶液中含有离子的判断,正确的是
A.一定含有H+、Mg2+、Ba2+、Cl-、 |
B.一定含有H+、Mg2+、C1-,一定不含有 |
C.一定含有H+、Ba2+, ,一定不含有C1- ,一定不含有C1- |
D.一定含有H+、Mg2+,可能同时含有Cl-、 |
11.利用氢、氮、氧三种元素,按要求用符号回答下面问题:
(1)具有可燃性的气体单质______ 。
(2)化学性质稳定的气体单质______ 。
(3)由氢、氮两种元素组成的化合物______ 。
(4)由氢、氮、氧三种元素组成的化合物______ 。
(1)具有可燃性的气体单质
(2)化学性质稳定的气体单质
(3)由氢、氮两种元素组成的化合物
(4)由氢、氮、氧三种元素组成的化合物
12.表是元素周期表第三周期的元素,请回答:

(1)元素周期表每个方格中都标有元素的基本信息,左上角数字表示该元素的______ 。
(2)四种粒子结构示意图中属于同一种元素的是______ (填序号),该元素与钠元素形成化合物的化学式为______ 。
A B
B
C D
D

(1)元素周期表每个方格中都标有元素的基本信息,左上角数字表示该元素的
(2)四种粒子结构示意图中属于同一种元素的是
A
 B
B
C
 D
D
13.化学肥料对农作物的增产具有十分重要的作用,俗话说:“庄稼一枝花,全靠肥当家”。下面是农业生产中广泛施用的几种化学肥料:①NH4NO3 ②KNO3 ③NH4Cl ④

请回答:
(1)属于复合肥料的是______ (填序号,下同);
(2)属于铵态氮肥的是______ ,它们成分中都含有的离子是______ (填符号)。


请回答:
(1)属于复合肥料的是
(2)属于铵态氮肥的是
14.实验废液中含有AgNO3、Cu(NO3)2和Mg(NO3)2,为减少废液对环境的影响,实验小组的同学做了下面的实验。
(1)取废液样品,加入少量锌粉,充分反应后,过滤,向滤渣中加入稀盐酸,无明显现象,则滤渣中一定含有的金属是______ (填符号,下同)。
(2)另取废液样品加入过量锌粉,充分反应后,过滤,向滤渣中加入稀盐酸,有气泡产生,则滤液中含有的溶质是______ 。实验表明,加入过量锌粉能有效去除废液中的离子是______ 。
(1)取废液样品,加入少量锌粉,充分反应后,过滤,向滤渣中加入稀盐酸,无明显现象,则滤渣中一定含有的金属是
(2)另取废液样品加入过量锌粉,充分反应后,过滤,向滤渣中加入稀盐酸,有气泡产生,则滤液中含有的溶质是
15.铝在地壳中主要以铝土矿的形式存在,铝土矿的主要成分为A12O3(含有少量Fe2O3、SiO2等杂质)。工业上冶炼铝的工艺流程见图:

(1)铝土矿中的SiO2不溶于水,也不与盐酸反应,操作①的目的是______ 。
(2)操作③得到的 受热分解生成Al2O3,该反应的化学方程式为
受热分解生成Al2O3,该反应的化学方程式为______ ,铝土矿经过操作①~④的目的是______ 。
(3)在冰晶石作助熔剂条件下,高温电解A12O3得到金属铝,该反应的化学方程式为______ 。

(1)铝土矿中的SiO2不溶于水,也不与盐酸反应,操作①的目的是
(2)操作③得到的
 受热分解生成Al2O3,该反应的化学方程式为
受热分解生成Al2O3,该反应的化学方程式为(3)在冰晶石作助熔剂条件下,高温电解A12O3得到金属铝,该反应的化学方程式为
16.(1)某兴趣小组为探究甲烷的元素组成,经查询资料,采用图所示装置,制取并收集一定量甲烷气体进行实验。
(查询资料)
Ⅰ.甲烷是一种无色无味的气体,密度比空气小、难溶于水、有可燃性
Ⅱ.实验室常用醋酸钠和碱石灰固体共热制取甲烷,有关反应的化学反应方程式:

(实验装置)

请回答:
①实验室制取甲烷气体应选用的发生装置是______ (填序号,下同)收集装置是______ 。
②验纯后,点燃甲烷气体,在火焰上方罩一冷而干燥的烧杯(见图F),烧杯内壁有______ 生成然后向烧杯中倒入少量澄清石灰水,振荡,现象为______ 。由此推断,甲烷中一定含C、H两种元素,甲烷燃烧的化学反应方程式为______ 。
③进行实验②前,将甲烷气体通过装置E,目的是______ 。
(2)有一瓶因久置而失去标签的无色溶液,为鉴定该溶液的成分,小亮进行了下面的实验:
①取一支洁净试管,倒入3~5mL待测溶液,滴加2~3滴石蕊试液,石蕊试液变红色,该溶液呈______ (填“酸性”、“碱性”)。
②另取一支洁净试管,倒入3~5mL待测溶液,加入几粒锌粒后有气泡冒出,该溶液一定是______ 溶液。
③要确定该溶液是稀硫酸还是稀盐酸,小形还需要补充的实验是:
(查询资料)
Ⅰ.甲烷是一种无色无味的气体,密度比空气小、难溶于水、有可燃性
Ⅱ.实验室常用醋酸钠和碱石灰固体共热制取甲烷,有关反应的化学反应方程式:

(实验装置)

请回答:
①实验室制取甲烷气体应选用的发生装置是
②验纯后,点燃甲烷气体,在火焰上方罩一冷而干燥的烧杯(见图F),烧杯内壁有
③进行实验②前,将甲烷气体通过装置E,目的是
(2)有一瓶因久置而失去标签的无色溶液,为鉴定该溶液的成分,小亮进行了下面的实验:
①取一支洁净试管,倒入3~5mL待测溶液,滴加2~3滴石蕊试液,石蕊试液变红色,该溶液呈
②另取一支洁净试管,倒入3~5mL待测溶液,加入几粒锌粒后有气泡冒出,该溶液一定是
③要确定该溶液是稀硫酸还是稀盐酸,小形还需要补充的实验是:
| 实验步骤 | 实验现象 | 实验结论 |
17.山梨酸(分子式为C6H8O2)和山梨酸钾是国际上应用最广的防腐剂,广泛应用于食品、饮料、医药、化妆品等行业。

请回答:
(1)山梨酸分子中C、H、O三种原子的个数比为______。
(2)山梨酸中C、H、O三种元素的质量比为______。

请回答:
(1)山梨酸分子中C、H、O三种原子的个数比为______。
(2)山梨酸中C、H、O三种元素的质量比为______。
18.市售的食用纯碱往往含有少量氯化钠,探究小组以某品牌食用纯碱为样品测定其中Na2CO3的质量分数,实验过程如图:

请分析实验过程,回答:
(1)写出相关反应的化学方程式______。
(2)实验中加入“过量”CaCl2溶液,目的是______。
(3)若取用样品的质量为2.2g,且实验过程中无质量损失,最终得到沉淀的质量为2g。则2.2g纯碱样品中Na2CO3的质量为______克,该品牌食用纯碱中Na2CO3的质量分数为______。

请分析实验过程,回答:
(1)写出相关反应的化学方程式______。
(2)实验中加入“过量”CaCl2溶液,目的是______。
(3)若取用样品的质量为2.2g,且实验过程中无质量损失,最终得到沉淀的质量为2g。则2.2g纯碱样品中Na2CO3的质量为______克,该品牌食用纯碱中Na2CO3的质量分数为______。
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
